Hidrolasas: estructura, funciones, ejemplos
Las hidrolasas son enzimas que se encargan de hidrolizar distintos tipos de enlaces químicos en muchos compuestos diferentes. Entre los principales enlaces que hidrolizan se encuentran los enlaces éster, los glucosídicos y los peptídicos.
Dentro del grupo de las hidrolasas se han clasificado a más de 200 enzimas diferentes, agrupadas al menos en 13 conjuntos individuales; su clasificación se basa esencialmente en el tipo de compuesto químico que les sirve de sustrato.
![Modelado gráfico con herramientas bioinformáticas de la estructura de una hidrolasa (Fuente:Jawahar Swaminathan and MSD staff at the European Bioinformatics Institute [Public domain] Vía Wikimedia Commons)](/academia/assets/jpg/3936DD7DD5152BDD5EC6203F4A7F54E0.jpg)
Las hidrolasas son indispensables para la digestión de los alimentos en el intestino de los animales, puesto que se encargan de degradar gran parte de los enlaces que componen las estructuras carbonadas de los alimentos que estos ingieren.
Estas enzimas funcionan en medios acuosos, ya que necesitan moléculas de agua a su alrededor para añadir a los compuestos una vez escindan las moléculas. En palabras simples, las hidrolasas realizan una catálisis hidrolítica de los compuestos sobre los que actúan.
Por ejemplo, cuando una hidrolasa rompe un enlace covalente C-C, el resultado es, usualmente, un grupo C-OH y un grupo C-H.
Índice del artículo
Al igual que muchas enzimas, las hidrolasas son proteínas globulares organizadas en estructuras complejas que se organizan por medio de interacciones intramoleculares.
Las hidrolasas, como todas las enzimas, se unen a una o varias moléculas de sustrato en una región de su estructura que se conoce como “sitio activo”. Este sitio es un bolsillo o hendidura rodeada por muchos residuos de aminoácidos que facilitan el agarre o la unión del sustrato.
Cada tipo de hidrolasa es específica para un sustrato dado, lo que está determinado por su estructura terciaria y por la conformación de los aminoácidos que hacen su sitio activo. Esta especificidad fue planteada de forma didáctica por Emil Fischer como una especie de “llave y cerradura”.
En la actualidad se sabe que el sustrato, por lo general, induce cambios o distorsiones en la conformación de las enzimas y que las enzimas, a su vez, distorsionan la estructura del sustrato para conseguir que este “encaje” en su sitio activo.
Todas las hidrolasas tienen la función principal de romper enlaces químicos entre dos compuestos o dentro de la estructura de una misma molécula.
Existen hidrolasas para romper casi cualquier tipo de enlace: algunas degradan los enlaces éster entre los carbohidratos, otras los enlaces peptídicos entre los aminoácidos de las proteínas, otras los enlaces carboxílicos, etc.
La finalidad del proceso de hidrólisis de enlaces químicos catalizado por una enzima hidrolasa varía considerablemente. La lisozima, por ejemplo, se encarga de la hidrólisis de enlaces químicos con propósitos de protección del organismo que la sintetiza.
Esta enzima degrada los enlaces que mantienen unidos a los compuestos en la pared celular de las bacterias, con el objetivo de proteger al cuerpo humano de la proliferación bacteriana y una posible infección.
Las nucleasas son enzimas “fosfatasas” que tienen la capacidad de degradar a los ácidos nucleicos, lo que también puede representar un mecanismo de defensa celular contra virus de ADN o de ARN.
Otras hidrolasas, como las del tipo “serin proteasas”, degradan los enlaces peptídicos de las proteínas en el tracto digestivo para hacer asimilables a los aminoácidos en el epitelio gastrointestinal.
Incluso, las hidrolasas están implicadas en diversos eventos de producción de energía en el metabolismo celular, ya que las fosfatasas catalizan la liberación de moléculas de fosfato de los sustratos de alta energía como el piruvato, en la glucolisis.
Entre la gran diversidad de hidrolasas que han identificado los científicos, algunas se han estudiado con mayor hincapié que otras, puesto que están implicadas en muchos procesos esenciales para la vida celular.
Entre estas se encuentran la lisozima, las serín proteasas, las fosfatasas de tipo endonucleasas y las glucosidasas o glicosilasas.
Las enzimas de este tipo rompen las capas de peptidoglucano de la pared celular de las bacterias grampositivas. Esto por lo general termina provocando una lisis total de la bacteria.
Las lisozimas defienden el cuerpo de los animales de las infecciones bacterianas y son abundantes en las secreciones corporales en los tejidos que se encuentran en contacto con el ambiente, como, por ejemplo, las lágrimas, la saliva y las mucosidades.
La lisozima del huevo de gallina fue la primera estructura proteica que se cristalizó a través de rayos X. Dicha cristalización fue realizada por David Phillips, en 1965, en el Instituto Real de Londres.
El sitio activo de esta enzima está compuesto por el péptido Asparagina-Alanina-Metionina—Asparagina-Alanina-Glicina—Asparagina-Alanina-Metionina (NAM-NAG-NAM).
Las enzimas de este grupo se encargan de hidrolizar los enlaces peptídicos en péptidos y proteínas. Las más comúnmente estudiadas son la tripsina y la quimotripsina; sin embargo, existen muchos tipos diferentes de serín proteasas, las cuales varían respecto a la especificidad del sustrato y a su mecanismo de catálisis.
Las “serín proteasas” se caracterizan por poseer un aminoácido nucleofílico de tipo serina en su sitio activo, el cual funciona en la ruptura del enlace peptídico entre los aminoácidos. Las serín proteasas también son capaces de romper una gran variedad de enlaces ésteres.
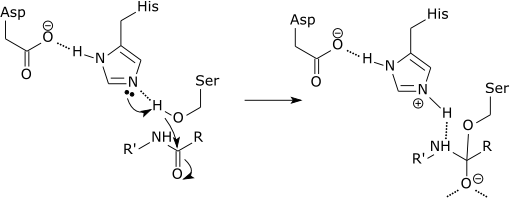
Estas enzimas cortan péptidos y proteínas de forma inespecífica. No obstante, todos los péptidos y proteínas a cortar deben unirse por el extremo N-terminal del enlace peptídico al sitio activo de la enzima.
Cada serín proteasa corta de forma precisa el enlace amida que se forma entre el extremo C-terminal del aminoácido en el extremo carboxilo y la amina del aminoácido que se encuentra hacia el extremo N-terminal del péptido.
Estas enzimas catalizan la escisión de los enlaces fosfodiésteres de los azúcares y los fosfatos de las bases nitrogenadas que componen a los nucleótidos. Existen muchos tipos diferentes de estas enzimas, ya que son específicas para el tipo de ácido nucleico y el sitio de corte.

Las endonucleasas son indispensables en el campo de la biotecnología, puesto que les permiten a los científicos modificar los genomas de los organismos cortando y sustituyendo fragmentos de la información genética de casi cualquier célula.
Las endonucleasas realizan el corte de las bases nitrogenadas en tres pasos. El primero es a través de un aminoácido nucleofílico, luego se forma una estructura intermediaria con carga negativa que atrae al grupo fosfato y finalmente rompe el enlace entre ambas bases.
- Davies, G., & Henrissat, B. (1995). Structures and mechanisms of glycosyl hydrolases. Structure, 3(9), 853-859.
- Lehninger, A. L., Nelson, D. L., Cox, M. M., & Cox, M. M. (2005). Lehninger principles of biochemistry. Macmillan.
- Mathews, A. P. (1936). Principles of biochemistry. W. Wood.
- Murray, R. K., Granner, D. K., Mayes, P., & Rodwell, V. (2009). Harper’s illustrated biochemistry. 28 (p. 588). New York: McGraw-Hill.
- Ollis, D. L., Cheah, E., Cygler, M., Dijkstra, B., Frolow, F., Franken, S. M., … & Sussman, J. L. (1992). The α/β hydrolase fold. Protein Engineering, Design and Selection, 5(3), 197-211.
