Acrilonitrilo: estructura, propiedades, producción, usos
El acrilonitrilo es un compuesto orgánico cuya fórmula condensada es CH2CHCN. Se trata de uno de los nitrilos más simples que existen. Química y estructuralmente no es más que el producto de la unión entre un grupo vinilo, CH2=CH-, y un grupo nitrilo, ciano o cianuro, C≡N. Es una sustancia con gran repercusión industrial en el mundo de los plásticos.
Físicamente, es un líquido incoloro, con cierto olor a cebolla, y que en estado impuro presenta tonalidades amarillentas. Es altamente inflamable, tóxico, y posiblemente cancerígeno, por lo que se clasifica como una sustancia extremadamente peligrosa. Irónicamente, con ella se fabrican plásticos y juguetes de la vida diaria, como los tupperware y los bloques de Lego.

A escalas industriales se produce el acrilonitrilo mediante el Proceso Sohio, aunque existen muchos otros métodos menos rentables por los cuales también puede sintetizarse. Casi toda la cantidad producida se destina a la fabricación de plásticos, basados en homopolímeros, como el poliacrilonitrilo, o en copolímeros, como el acrilonitrilo-butadieno-estireno.
Índice del artículo
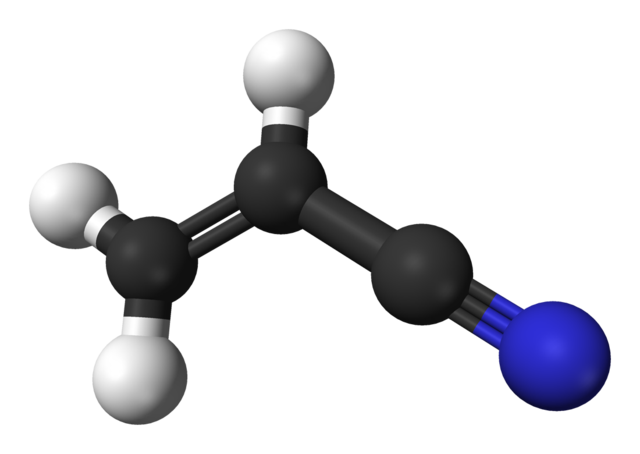
En la imagen superior tenemos la molécula de acrilonitrilo representada con un modelo de esferas y barras. Las esferas negras corresponden a los átomos de carbono, mientras las blancas y la azul a los átomos de hidrógeno y nitrógeno, respectivamente. El extremo izquierdo, CH2=CH- corresponde al grupo vinilo, y el derecho, al grupo ciano, C≡N.
Toda la molécula es plana, pues los carbonos del grupo vinilo tienen hibridación sp2. Mientras, el carbono del grupo ciano tiene hibridación sp, estando junto al átomo de nitrógeno en una línea que descansa en el mismo plano que el resto de la molécula.
El grupo CN aporta polaridad a la molécula, por lo que la molécula CH2CHCN establece un dipolo permanente donde la mayor densidad electrónica se dirige hacia el átomo de nitrógeno. Por lo tanto, las interacciones dipolo-dipolo están presentes, y son las responsables de que el acrilonitrilo sea un líquido que hierva a 77 ºC.
Las moléculas CH2CHCN son planas, pudiéndose esperar que en sus cristales (solidificados a -84 ºC) se dispongan unas sobre otras como láminas u hojas de papel, de tal modo que sus dipolos no se repelan.
Líquido incoloro pero con tonalidades amarillentas cuando presenta algunas impurezas. Cuando es así, recomiendan destilarlo previo a su uso. Es volátil y tiene además un olor intenso parecido al de la cebolla.
53,064 g/mol
-84 ºC
77 ºC
-5 ºC (copa cerrada)
0 ºC (copa abierta)
481 ºC
0,81 g/cm3
1,83 en relación al aire.
109 mmHg a 25 ºC
En el agua tiene una solubilidad de 74 g/L a 25 ºC. El acrilonitrilo también es considerablemente soluble en acetona, éter de petróleo, etanol, etil acetato y benceno.
Cuando se descompone térmicamente libera gases tóxicos de cianuro de hidrógeno, óxidos de carbono y óxidos de nitrógeno.
El acrilonitrilo puede producirse a masivas escalas mediante numerosas reacciones y procesos químicos. De todos ellos, el Proceso Sohio es el más utilizado, el cual consiste de la amoxidación catalítica del propileno. En un reactor de lecho fluidizado, el propileno se mezcla con aire y amoníaco a una temperatura alrededor de los 400 y 510 ºC, donde reaccionan sobre catalizadores sólidos.
Los reactantes entran al reactor una sola vez, teniendo lugar la siguiente reacción:
2CH3−CH=CH2 + 2 NH3 + 3 O2 → 2 CH2=CH–C≡N + 6 H2O
Nótese que el oxígeno se reduce a agua, mientras el propileno se oxida a acrilonitrilo. De ahí el nombre ‘amoxidación’, pues es una oxidación que involucra la participación del amoníaco.
Además del Proceso Sohio, pueden mencionarse otras reacciones que permiten la obtención del acrilonitrilo. Evidentemente, no todas ellas son escalables, o al menos de un modo lo suficiente rentable, ni generan productos con un alto rendimiento o pureza.
El acrilonitrilo se sintetiza partiendo, nuevamente, del propileno, pero haciéndolo reaccionar con el óxido nítrico sobre catalizadores de PbO2-ZrO2 en forma de aerogel. La reacción es como sigue:
4 CH3−CH=CH2 + 6 NO → 4 CH2=CH–C≡N + 6 H2O + N2
Una reacción que no involucra el propileno es la que empieza con el óxido de etileno, el cual reacciona con el cianuro de hidrógeno para transformarse en el etileno cianohidrina; y posteriormente, se deshidrata a una temperatura de 200 ºC en el acrilonitrilo:
EtO + HCN → CH2OHCH2CN
CH2OHCH2CN + Q (200 ºC) → CH2=CH–C≡N + H2O
Otra reacción mucho más directa es la adición del cianuro de hidrógeno sobre el acetileno:
HC≡CH + HCN → CH2=CH–C≡N
Sin embargo, se forman muchos productos secundarios, por lo que la calidad del acrilonitrilo es inferior comparada a la del Proceso Sohio.
Además de las sustancias ya mencionadas, el lactonitrilo, el propionitrilo, y el propanal o propaldehído, también sirve como materiales de partida para la síntesis del acrilonitrilo.

El acrilonitrilo es una sustancia indispensable para la industria de los plásticos. Varios de sus plásticos derivados son altamente conocidos. Tal es el caso del copolímero acrilonitrilo-butadieno-estireno (ABS, por sus siglas en inglés), con el que se fabrican las piezas de los Legos. Asimismo, tenemos las fibras acrílicas, elaboradas con el homopolímero poliacrilonitrilo (PAN).
Entre otros plásticos que contienen al acrilonitrilo como monómero, o que dependen de él para su fabricación, tenemos: el estireno acrilonitrilo (SAN), el acrilonitrilo butadieno (NBR), el acrilonitrilo estireno acrilato (ASA), la poliacrilamida, y los cauchos sintéticos y resinas de nitrilo.
Prácticamente, cualquier polímero natural, como el algodón, puede modificarse al incorporar al acrilonitrilo a sus estructuras moleculares. Así, se obtienen derivados de nitrilo, lo que vuelve la química del acrilonitrilo muy amplia.
Uno de sus usos fuera del mundo de los plásticos es como pesticida mezclado con tetracloruro de carbono. Sin embargo, debido a su terrible impacto sobre el ecosistema marino, tales pesticidas se han prohibido o están sujetos a fuertes restricciones.
El acrilonitrilo es una sustancia peligrosa, por lo que debe manipularse con extremo cuidado. Cualquier exposición inapropiada o excesivamente prolongada a este compuesto puede ser letal, ya sea por inhalación, ingesta o contacto físico.
Debe mantenerse lo más alejado posible de toda fuente de calor, ya que es un líquido volátil y muy inflamable. Tampoco debe estar en contacto con el agua, pues reacciona violentamente con ella.
Además de esto, es una sustancia posiblemente cancerígena, al cual se le ha asociado con cánceres del hígado y pulmón. Quienes se han visto expuesto a esta sustancia presentan incrementos de los niveles de tiocianato excretado en la orina, y de cianuros en la sangre producto de la metabolización del acrilonitrilo.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Acrylonitrile. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Acrylonitrile. PubChem Database., CID=7855. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Acrylonitrile. ScienceDirect. Recuperado de: sciencedirect.com
- Korry Barnes. (2020). What is Acrylonitrile? – Uses & Properties. Study. Recuperado de: study.com
- Pajonk, G.M., Manzalji, T. (1993). Synthesis of acrylonitrile from propylene and nitric oxide mixtures on PbO2-ZrO2 aerogel catalysts. Catal Lett 21, 361–369. doi.org/10.1007/BF00769488
