Grupo amino (NH2): estructura, propiedades, ejemplos
El grupo amino es aquel que está presente en varios compuestos orgánicos nitrogenados, por ejemplo las aminas, y se representa con la fórmula -NH2. Las aminas son los compuestos más representativos donde encontramos a este grupo, ya que cuando son alifáticas tienen por fórmula RNH2; mientras que cuando son aromáticas, tienen por fórmula ArNH2.
Las amidas, RC(O)NH2, con el grupo carbonilo C=O, también son otro ejemplo de compuestos que contienen el grupo amino. En muchos otros compuestos, los grupos aminos se encuentran como meros sustituyentes, pues en el resto de la estructura puede haber grupos oxigenados con mayor relevancia química.

El grupo amino se considera un producto derivado del amoníaco, NH3. A medida que se sustituyen sus tres enlaces N-H por enlaces N-C, van surgiendo aminas primarias, secundarias y terciarias, respectivamente. El mismo razonamiento aplica para las amidas.
Los compuestos con grupos aminos se caracterizan por ser sustancias básicas o alcalinas. Asimismo, forman parte de un sinfín de biomoléculas, como las proteínas y enzimas, y de productos farmacéuticos. De todos los grupos funcionales, es probablemente el más diverso debido a las sustituciones o transformaciones que es capaz de sufrir.
Índice del artículo
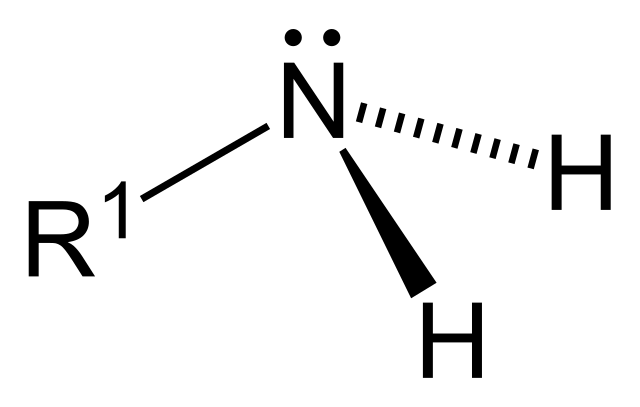
En la imagen superior tenemos la fórmula estructural del grupo amino. En ella se deja descubierta su geometría molecular, la cual es tetraédrica. La cadena lateral alifática R1, y los dos átomos de hidrógeno H, se posicionan en los extremos de un tetraedro, mientras el par solitario de electrones se ubica en el extremo superior. De allí que las cuñas se alejen o salgan del plano del observador.
Desde un punto de vista estereoquímico, el grupo NH2 tiene mucha movilidad; es dinámico, su enlace R1-N puede rotar o vibrar, y lo mismo sucede con sus enlaces N-H. La geometría de este grupo no se ve afectada por la incorporación de otras cadenas laterales R2 o R3.
Esto significa que la geometría tetraédrica observada para esta amina primaria, sigue siendo la misma que para las aminas secundarias (R2NH) o terciarias (R3N). Sin embargo, es normal esperarse que los ángulos del tetraedro se distorsionen, ya que habrá mayor repulsión electrónica entorno al átomo de nitrógeno; es decir, R1, R2 y R3 se repelerán mutuamente.
Y sin mencionar el espacio que ocupa el par solitario de electrones sobre el nitrógeno, el cual puede formar enlaces con los protones del medio. De aquí se debe la basicidad del grupo amino.
El grupo amino se caracteriza por ser básico. Por lo tanto, sus disoluciones acuosas deben tener valores de pH por encima de 7, predominando la presencia de los aniones OH–. Esto se explica mediante su equilibrio de hidrólisis:
RNH2 + H2O ⇌ RNH3+ + OH–
Siendo RNH3+ el ácido conjugado resultante. La cadena lateral R ayuda a disminuir la densidad de carga positiva que ahora aparece en el átomo de nitrógeno. Así, mientras más grupos R haya, menor se “sentirá” dicha carga positiva, por lo que la estabilidad del ácido conjugado irá en aumento; lo que a su vez, implica que la amina sea más básica.
Un razonamiento similar puede aplicarse considerando que las cadenas R aportan densidad electrónica al átomo de nitrógeno, “reforzando” la densidad negativa del par solitario de electrones, con lo cual aumenta el carácter básico de la amina.
Se dice entonces que la basicidad del grupo amino aumenta conforme esté más sustituido. De todas las aminas, las terciarias son las más básicas. Igualmente sucede con las amidas y otros compuestos.
Los grupos aminos confieren polaridad a la molécula a la que estén enlazados debido a su átomo electronegativo de nitrógeno.
Por lo tanto, los compuestos que tienen NH2 no solo son básicos, sino que además son polares. Esto significa que tienden a solubilizarse en solventes polares como el agua o los alcoholes.
Sus puntos de fusión o ebullición asimismo son considerablemente altos, producto de las interacciones dipolo-dipolo; específicamente, de los puentes de hidrógenos que se establecen entre dos NH2 de moléculas vecinas (RH2N—HNHR).
Es de esperarse que mientras más sustituido esté el grupo amino, menos probable será que forme un puente de hidrógeno. Por ejemplo, las aminas terciarias ni siquiera pueden establecer uno porque carecen completamente de hidrógenos (R3N:—:NR3).
Aun cuando el grupo NH2 aporte polaridad y fuertes interacciones moleculares al compuesto, su efecto es menor comparado, por ejemplo, al de los grupos OH o COOH.
Aunque el grupo amino se distingue por su basicidad, también tiene cierto carácter ácido: reaccionará con las bases fuertes o podrá ser neutralizado por estas. Considérese la siguiente reacción de neutralización:
RNH2 + NaOH → RNHNa + H2O
En ella se forma el anión RNH–, el cual atrae electrostáticamente el catión de sodio. El agua es una base débil comparada con el NaOH o KOH, capaces de neutralizar el NH2 y hacer que este se comporte como un ácido.
A continuación se enlistarán algunos ejemplos de compuestos que contienen el grupo NH2, sin sustituciones; es decir, no se considerarán las aminas secundarias o terciarias. Tenemos entonces:
-Metilamina, CH3NH2
-Etilamina, CH3CH2NH2
-Butanamina, CH3CH2CH2CH2NH2
-Isobutilamina, (CH3)2CHNH2
-Formamida, HCONH2
-Hidroxilamina, NH2OH
-Bencilamina, C6H5CH2NH2
-Acrilamida, CH2=CHCONH2
-Fenilamina, C6H5NH2
-Arginina, con R= -(CH2)3NH-C(NH)NH2
-Asparagina, con R = -CH2CONH2
-Glutamina, con R= -CH2CH2CONH2
-Lisina, con R= -(CH2)4NH2
Los últimos cuatros ejemplos corresponden a aminoácidos, piezas fundamentales con las que se construyen las proteínas y en cuyas estructuras moleculares presentan tanto el grupo NH2 como el grupo COOH.
Estos cuatro aminoácidos contienen en sus cadenas laterales R un grupo NH2 adicional, por lo que al formarse el enlace peptídico (unión de dos aminoácidos mediante sus extremos NH2 y COOH) no desaparece el NH2 en las proteínas resultantes.
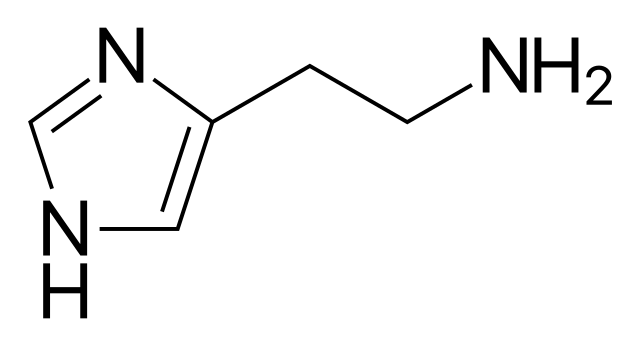
Además de los aminoácidos, en el cuerpo humano tenemos otros compuestos portadores del grupo NH2: tal es el caso de la histamina (arriba), uno de muchos neurotransmisores. Nótese lo altamente nitrogenada que es su estructura molecular.
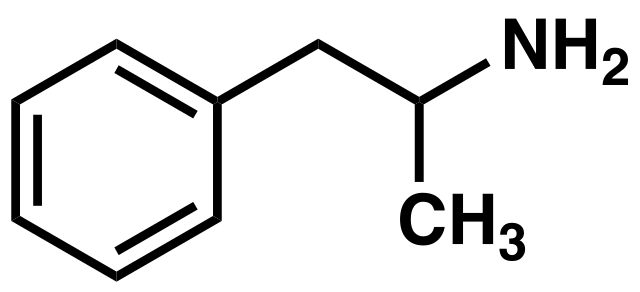
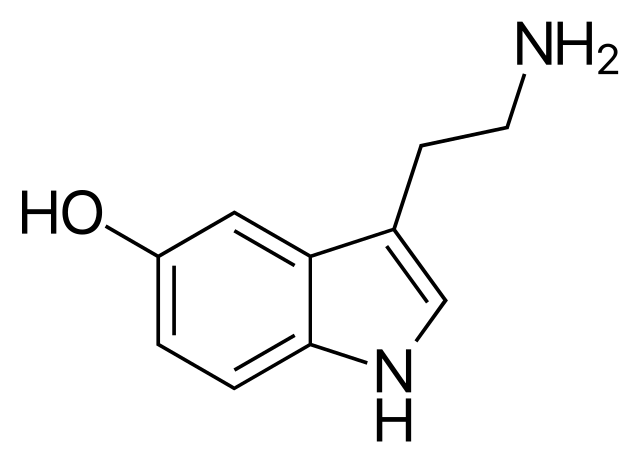
Y finalmente, tenemos otros ejemplos de sustancias que juegan un rol en el sistema nervioso central: la anfetamina y la serotonina. La primera es un estimulante usado para tratar algunos trastornos psíquicos, y la segunda es un neurotransmisor asociado popularmente con la felicidad.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Amine. Recuperado de: en.wikipedia.org
- Peter A.S. Smith & Eric Block. (2020). Amine. Encyclopædia Britannica. Recuperado de: britannica.com
- Brian C. Smith. (01 de marzo de 2019). Organic Nitrogen Compounds II: Primary Amines. Recuperado de: spectroscopyonline.com
- William Reusch. (05 de mayo de 2013). Chemistry of Amines. Recuperado de: 2.chemistry.msu.edu
