Ácido peracético: estructura, propiedades, obtención, usos
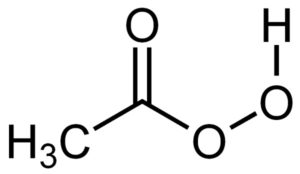
El ácido peracético es un compuesto orgánico líquido cuya fórmula química es C2H4O3. Es el peróxido del ácido acético, por lo que se le conoce también como ácido peroxiacético. Su molécula es semejante a la del ácido acético CH3COOH pero con un oxígeno adicional en el carboxilo.
Pertenece a la clase de los peróxidos orgánicos, que son moléculas hechas por el hombre. Las propiedades germicidas y esterilizantes de sus soluciones acuosas se conocen desde 1902. Esta acción puede en algunos casos ejercerla a concentraciones tan bajas como 0,001%.

Esta propiedad hace que se utilice ampliamente en clínicas y hospitales para esterilizar equipos médicos, con la ventaja adicional de que sus productos de descomposición no son tóxicos para el ser humano.
Las soluciones de PAA son fuertemente oxidantes, característica que ha sido utilizada para blanquear pulpa de papel o en lavanderías. También se aplica para la ejecución de reacciones químicas en las que se requiera esta propiedad, como la epoxidación e hidroxilación.
Su acción oxidante y desinfectante tiene uso en la limpieza de equipos donde se procesan alimentos y bebidas. Además, resulta corrosivo para algunos metales y al ser almacenado debe mantenerse alejado de compuestos orgánicos o fácilmente oxidables.
Reseñar que sus soluciones concentradas pueden resultar explosivas, razón por la cual debe prepararse preferiblemente diluido y almacenarse en lugares fríos. Su fuerza corrosiva también se aplica a piel, mucosas y tejidos del ser humano, por lo que debe manipularse con precaución y con equipo protector.
Índice del artículo
El ácido peroxiacético posee una molécula muy similar a la del ácido acético pero con un oxígeno adicional en la estructura del grupo –COOH, pues posee 3 átomos de oxígeno en lugar de dos.
– Ácido peracético
– Ácido peroxiacético
– Ácido etanoperoxoico
– PAA (siglas del inglés PeroxiAcetic Acid).
Líquido incoloro claro con un olor punzante a vinagre.
76,05 g/mol
110 ºC (con explosión)
40,5 ºC (método de copa abierta)
200 ºC (es la temperatura a la cual arde espontáneamente)
1,226 g/cm3 a 15 ºC
3,280 cP a 25,6 ºC
1,3974 a 20 ºC
Es miscible con el agua en cualquier proporción. Es soluble en solventes orgánicos polares, como el etanol. Ligeramente soluble en solventes aromáticos. Muy soluble en éter y en ácido sulfúrico.
Menor a 2.
pKa = 8,20 a 25 ºC (es más débil que el ácido acético que tiene pKa = 4,8)
Como ácido el PAA es mucho más débil que el ácido del cual proviene, el ácido acético.
Presenta un alto potencial como oxidante. Es altamente reactivo por lo que es difícil de almacenar y esto ha limitado su uso.
Sus productos de degradación son ácido acético CH3COOH, oxígeno O2, peróxido de hidrógeno H2O2 y agua H2O. El H2O2 a su vez se degrada a agua y oxígeno. Todos estos compuestos son ambientalmente seguros.
Es un agente epoxidante e hidroxilante para enlaces olefínicos (enlaces dobles C=C). Esto significa que participa activamente en la formación de epóxidos en dobles enlaces de moléculas orgánicas y en la adición de grupos –OH en estos.
El PAA es corrosivo hacia algunos metales como el acero liso, hierro galvanizado, cobre, latón y bronce. Otros metales son resistentes como el acero inoxidable, aluminio puro y hierro estañado.
Ataca las gomas sintéticas y naturales y extrae el plastificante de algunos polímeros vinílicos.
Tiene un olor punzante y acre que recuerda al del ácido acético (el ácido acético es el componente principal del vinagre).
Al hacer reaccionar ácido acético glacial (anhidro, es decir, sin agua) con peróxido de hidrógeno H2O2 en presencia de un ácido mineral (como ácido sulfúrico H2SO4), parte del ácido acético se oxida y se obtienen soluciones acuosas de ácido peracético, ácido acético y H2O2.
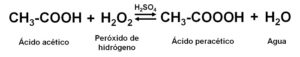
El H2SO4 actúa como catalizador o acelerador de la reacción. Se emplean agentes estabilizadores, como el ácido piridino-2,6-dicarboxílico.
Si se destilan estas soluciones se puede obtener una concentración más alta de ácido peracético.
También se puede obtener por oxidación de acetaldehído CH3CHO con ozono O3, o por reacción del anhídrido acético (CH3CO)2O con H2O2.
Otra forma de obtenerlo justo en el sitio donde se requiere es añadiendo tetra-acetil-etilendiamina (TAED) a una solución alcalina de H2O2.
El PAA actúa como desinfectante de equipos médicos en clínicas, hospitales, consultorios médicos y odontológicos.
Algunas fuentes reportan que su acción contra los microorganismos puede ser clasificada de manera general así: bacteria > virus > esporas de bacterias > quistes de protozoarios. Esto significa que es más efectivo contra las bacterias y menos efectivo contra los quistes de protozoarios.
En estudios realizados sobre la acción bactericida del PAA y otros desinfectantes de alto nivel contra Staphylococcus aureus y Pseudomonas aeruginosa en equipos para endoscopia, el PAA demostró ser el más rápido en su efecto microbicida.
El Staphylococcus aureus puede producir infecciones en tejidos blandos, en la piel, neumonías y e infección de los tejidos del corazón. La Pseudomonas aeruginosa puede producir neumonía.
Las bacterias forman biopelículas que las protegen de estímulos externos o estrés, mediante una gruesa capa de proteínas extracelulares, polisacáridos y ácidos nucleicos.
Estas biopelículas son altamente resistentes a antibióticos y desinfectantes comunes. En equipos como los endoscopios suelen formarse en los canales estrechos de estos, debido a rutinas no adecuadas o no efectivas de limpieza y desinfección.
El PAA ataca estas biopelículas probablemente mediante oxidación de los enlaces moleculares más sensibles de las proteínas, enzimas y otros metabolitos. Esto conduce a la ruptura de las paredes celulares de los gérmenes, sus esporas y quistes.
Además, al penetrar dentro de la célula el PAA puede oxidar enzimas esenciales, perjudicando el transporte de moléculas y procesos bioquímicos vitales.
Los tiempos de desinfección se han establecido desde hace algunos años, pero durante ciertos estudios se observó que el tratamiento con PAA originó cambios en la forma de las células luego de tan solo 5 minutos, con formación de bolsas o abultamientos en la pared celular de las bacterias, y colapso de las estructuras celulares de los microorganismos luego de 30 minutos.
Aunque el PAA destacó por su rapidez, los investigadores han recomendado reevaluar los tiempos establecidos en los protocolos de limpieza y desinfección, aumentándolos para la mayoría de los antisépticos de alto nivel, para asegurar una total efectividad de estos.
Uno de los aspectos negativos del PAA es que hay algunos patógenos hacia los que no es muy efectivo, como por ejemplo los quistes de la Giardia lamblia y de Cryptosporidium parvum (parásitos que pueden producir diarrea u otras afecciones intestinales).
El efecto desinfectante del PAA en efluentes de aguas de desecho municipales o de industrias se ha investigado desde hace más de 30 años.

Entre sus ventajas está el amplio espectro de su actividad germicida aún en presencia de materia orgánica, así como el hecho de que no se generan productos secundarios dañinos al ambiente.
La efectividad de su acción parece depender entre otros factores de la cantidad de materia orgánica presente en el efluente, del tipo y cantidad de microorganismos a eliminar, de la concentración del PAA en el agua a tratar, del pH y de la duración del tratamiento.
En algunos casos, el PAA ha demostrado ser mejor que el hipoclorito de sodio para desinfectar aguas de desecho en climas tropicales y ha resultado efectivo contra el virus del cólera, entre muchos otros patógenos.
Sin embargo, unos de los puntos negativos es que debido al ácido acético remanente luego de la desinfección, el efluente de agua queda cargado de materia orgánica, lo que aumenta el riesgo de nuevo crecimiento de microorganismos.
Por otra parte, es un producto costoso, por lo que aún no es muy competitivo por ejemplo con el hipoclorito de sodio debido a este aspecto.
Por ser un agente oxidante fuerte es muy efectivo contra los microorganismos a bajas temperaturas y esto ha dado lugar a su amplia utilización como bactericida y fungicida en el procesamiento de alimentos y bebidas.
Esto incluye plantas de procesamiento de carne y pollo, lácteos, cervecerías, vinaterías o bodegas de vino y plantas de fabricación de refrescos. En todos estos lugares se aplica el PAA por ser ideal para limpieza in situ (en el sitio).
Las enzimas encontradas en algunos alimentos como la peroxidasa y la catalasa, las cuales desactivan al peróxido de hidrógeno H2O2, no ejercen efecto dañino sobre el ácido peracético. Los residuos de proteínas tampoco lo perjudican.
Debido al hecho de que en los alimentos el PAA se descompone en ácido acético y agua oxigenada, se considera seguro su uso en aplicaciones en las que no se enjuagan los alimentos.
Sirve como desinfectante y esterilizante para tanques de acero inoxidable y de vidrio, tuberías y camiones cisterna, que sirven para el transporte y almacenamiento de bebidas.

Su característica de generar productos no tóxicos y que en alta dilución no producen sabores ni olores, constituyen ahorro de tiempo y dinero para estas industrias.
El ácido peracético es un agente importante libre de cloro en la tecnología de blanqueamiento en la industria de producción de pulpa de papel.
Algunos autores consideran al ácido peracético como un derivado activado del H2O2, en donde uno de los hidrógenos de este ha sido sustituido por un grupo acilo CH3C(=O)—.
Como resultado de esto, el ácido peracético reacciona con sustratos orgánicos en un mayor grado que el H2O2 y que puede utilizarse en reacciones de oxidación bajo condiciones más moderadas que con H2O2.
Bajo condiciones neutras o moderadamente alcalinas el ion peracetato CH3C(=O)OO— por ser un nucleófilo fuerte (es atraído por átomos deficientes en electrones), remueve selectivamente cromóforos o compuestos coloreados presentes en la pulpa de papel.
Esto permite a estas industrias disponer de un blanqueador muy efectivo y cuyos residuos no contaminan sus efluentes acuosos.
El ácido peracético sirve como oxidante para preparar compuestos epóxicos, como catalizador para fabricar resinas de poliéster y en la obtención de caprolactama y glicerol.
Algunos investigadores han logrado recuperar materiales útiles al tratar ciertos desechos poliméricos con soluciones de PAA.
El proceso se realiza mediante oxidación de ciertos desechos de polímeros reforzados con fibra de carbono provenientes de actividades aeroespaciales, con soluciones de ácido acético glacial y peróxido de hidrógeno.
De esta forma se genera ácido peracético in situ, el cual descompone la resina epóxica en un 97% dejando intacta la fibra de carbono.
Luego, mediante destilación se recupera más del 90% del ácido acético, resultando en la descomposición adicional del polímero que genera compuestos alifáticos y fenólicos recuperables.
La fibra de carbono se obtiene limpia, y mantiene su longitud y resistencia a la tracción comparables a las de las fibras vírgenes.

El proceso se efectúa bajo condiciones suaves, sin emisiones gaseosas, lo que lo hace ambientalmente amigable.
Por su poder oxidante de compuestos coloreados, el ácido peracético es empleado en blanqueamientos de lavandería. En estos casos se utiliza la mezcla de tetra-acetil-etilendiamina con H2O2 en medio alcalino para obtenerlo en el sitio.
Su intervalo de aplicación es muy amplio, pues puede emplearse en aguas duras o que contienen alta proporción de sales de calcio y magnesio, a pH entre 3,0 y 7,5 y temperaturas de 0 a 40 ºC.
El ácido peracético o PAA puede ser altamente corrosivo. Es fuertemente irritante para la piel y los ojos.
Si se ingieren sus soluciones causa corrosión de las membranas mucosas de boca, garganta, esófago y del tracto gastrointestinal, causando dolor y dificultad para tragar.
Si se inhalan sus vapores se produce irritación del tracto respiratorio y si la inhalación es prolongada se produce edema en los pulmones.
Las soluciones que contienen más del 15% de PAA comienzan a exhibir cierto grado de inestabilidad y explosividad y se deben evitar golpes o sacudidas. Pueden descomponerse de forma explosiva. Si la concentración de PAA en solución supera el 56% puede detonar debido a la evaporación violenta de ácido acético.
Debe evitarse el calor. Se considera un líquido inflamable. Su descomposición es violenta con explosión a 110 ºC. Debe almacenarse en lugares frescos, preferiblemente bajo refrigeración, o en lugares muy bien ventilados.
Es fuertemente oxidante, por lo tanto, peligroso en contacto con materiales orgánicos. Al ser almacenado debe aislarse de otros compuestos, especialmente de compuestos orgánicos, combustibles, inflamables u oxidables. Debe separarse de ácidos, álcalis y metales pesados.
Cuando se calienta hasta descomposición emite vapores acres e irritantes, los cuales irritan ojos, nariz y garganta.
Si se derrama no se debe permitir fluir hacia los desagües porque en estos se crea un peligro de incendio o explosión.
Como medidas preventivas para su manipulación se recomiendan guantes de goma y ropa de protección, escudo facial o protección ocular (anteojos o gafas de seguridad), protección respiratoria y no comer, beber, ni fumar durante el trabajo con sus soluciones.
- U.S. National Library of Medicine. (2019). Peracetic acid. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Das, M. et al. (2018). An Efficient Method of Recycling of CFRP Waste Using Peracetic Acid. ACS Sustainable Chemistry & Engineering. Recuperado de pubs.acs.org.
- Chino, T. et al. (2017). Morphological bactericidal fast-acting effects of peracetic acid, a high-level disinfectant, against Staphylococcus aureus and Pseudomona aeruginosa biofilms in tubing. Antimicrob Resist Infect Control. 2017: 6: 122. Recuperado de ncbi.nlm.nih.gov.
- Pan, G.X. et al. (1999). Reactivity of Ferulic Acid and Its Derivatives toward Hydrogen Peroxide and Peracetic Acid. J. Agric. Food Chem. 1999, 47, 3325-3331. Recuperado de pubs.acs.org.
- Kitis, Mehmet. (2004). Disinfection of wastewater with peracetic acid: a review. Environment International 30 (2004) 47-55. Recuperado de sciencedirect.com.
