Dihidroxiacetona fosfato (DHAP): características y aplicaciones
La dihidroxiacetona fosfato es un compuesto químico abreviado bajo las siglas DHAP. Es un intermediario en algunas rutas metabólicas de organismos vivos, como la degradación glucolítica o glucólisis, así como en el ciclo de Calvin en las plantas.
Bioquímicamente, la DHAP es el producto de la acción de una enzima aldolasa sobre la fructosa-1,6-bifosfato (FBP), que ocasiona una ruptura aldolítica dando como resultado dos compuestos de tres carbonos: DHAP y gliceraldehido 3-fosfato (GAP).
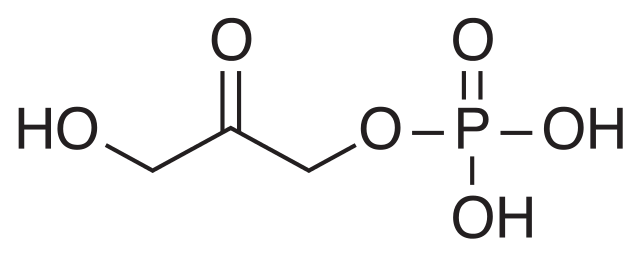
En el ciclo de Calvin la aldolasa realiza la reacción inversa, condensando moléculas de DHAP con moléculas de GAP para formar una hexosa.
Índice del artículo
- 1 Características
- 2 DHAP en la glucólisis
- 3 DHAP en el ciclo de Calvin
- 4 DHAP en la gluconeogénesis
- 5 Referencias
La DHAP se clasifica dentro de las moléculas conocidas como cetotriosas. Estas son monosacáridos constituidos por una cadena de tres carbonos (triosas) con el grupo carbonilo en el carbono central (C2).
El GAP y la DAHP son isómeros funcionales y conforman los carbohidratos más simples dentro de las moléculas orgánicas biológicamente activas.
A pesar de que la estructura química de muchos carbohidratos comunes como GAP y DHAP son de aldehídos y cetonas, se les confiere el término de carbohidrato, por referirse a derivados directos de sacáridos.
En la glicólisis una serie de reacciones degradan a la glucosa hasta piruvato. Esta degradación ocurre de forma progresiva en 10 pasos consecutivos, donde intervienen distintas enzimas y se producen una variedad de intermediarios, los cuales están todos fosforilados.
La DHAP aparece en la glucólisis en la cuarta reacción de este proceso, que consiste en la ruptura de la FBP en dos carbohidratos de tres carbonos (triosas), de las cuales solamente el GAP continúa la secuencia de la glicólisis, mientras que la DHAP necesita ser transformada en GAP para seguir dicha ruta.
Dicha reacción es catalizada por una aldolasa (fructosa bifosfato aldolasa), que lleva a cabo una rotura aldólica entre los carbonos C3 y C4 de la FBP.
Esta reacción solo se produce si la hexosa a dividirse posee un grupo carbonilo en C2 y un hidroxilo en C4. Por esta razón, ocurre previamente la isomerización de la glucosa-6-fosfato (G6P) en fructosa 6-fosfato (F6P).
En la quinta reacción de la glucólisis también está involucrada la DHAP, tratándose de su isomerización a GAP por la enzima triosa fosfato isomerasa o TIM. Con esta reacción se completa la primera fase de la degradación de la glucosa.
En la ruptura aldólica se producen dos intermediarios, donde la DHAP conforma el 90% de la mezcla en equilibrio.
Existen dos tipos de aldolasas: a) la aldolasa tipo I está presente en las células animales y vegetales y se caracteriza por la formación de una base de Schiff entre el sitio activo enzimático y el carbonilo de la FBP. b) La aldolasa tipo II se encuentra en algunas bacterias y en hongos, esta posee un metal en el sitio activo (generalmente Zn).
La rotura aldólica comienza con la adhesión del sustrato al sitio activo y la remoción de un protón del grupo β-hidroxilo, formándose la base de Schiff protonada (catión iminio). La ruptura de los carbonos C3 y C4 produce la liberación del GAP y la formación de un intermediario llamado enamina.
La enamina es posteriormente estabilizada, por lo que se forma un catión iminio que es hidrolizado, con lo que se libera finalmente la DHAP y se regenera así la enzima libre.
En las células con aldolasa tipo II no ocurre la formación de la base de Schiff, siendo un catión divalente metálico, generalmente Zn2+, el que estabiliza al intermediario enamina para poder liberar la DHAP.
Como se ha mencionado, la concentración en equilibrio de la DHAP es mayor que la de GAP, de manera que las moléculas de DHAP van siendo transformadas en GAP a medida que este último va siendo utilizado en la reacción siguiente de la glucólisis.
Esta transformación ocurre gracias a la enzima TIM. Esta es la quinta reacción del proceso de degradación glucolítica y en ella los carbonos C1 y C6 de la glucosa pasan a ser los carbonos C3 del GAP, mientras que los carbonos C2 y C5 se convierten en el C2 y los C3 y C4 de la glucosa se transforman en el C1 del GAP.
La enzima TIM es considerada como la “enzima perfecta” debido a que la difusión controla la velocidad de la reacción, lo que significa que el producto es formado con igual rapidez con que se juntan el sitio activo de la enzima y su sustrato.
En la reacción de transformación de la DHAP a GAP se forma un intermediario llamado enediol. Este compuesto es capaz de ceder los protones de los grupos hidroxilos a un residuo del sitio activo de la enzima TIM.
El ciclo de Calvin es el ciclo de reducción fotosintética del carbono (PCR) que constituye la fase oscura del proceso de fotosíntesis en las plantas. En esta etapa, los productos (ATP y NADPH) obtenidos en la fase luminosa del proceso, se utilizan para fabricar carbohidratos.
En este ciclo se forman seis moléculas de GAP, de las cuales dos son transformadas en DHAP por isomerización, gracias a la acción de la enzima TIM, en una reacción inversa a la ocurrida en la degradación de la glucólisis. Esta reacción es reversible, aunque el equilibrio, en el caso de este ciclo y, a diferencia de la glucólisis, está desplazado hacia la conversión de GAP hacia DHAP.
Estas moléculas de DHAP pueden luego seguir dos vías, una es una condensación aldólica catalizada por una aldolasa, en la que se condensa con una molécula de GAP para formar FBP.
La otra reacción que puede tomar una de las DHAP es una hidrólisis de fosfato catalizada por una sedoheptulosa bifosfatasa. En esta última vía reacciona con una eritrosa para formar sedoheptulosa 1,7-bifosfato.
En la gluconeogénesis algunos compuestos no glucídicos como piruvato, lactato y algunos aminoácidos son convertidos en glucosa. En este proceso, la DHAP aparece de nuevo por la isomerización de una molécula de GAP por acción de la TIM, para luego mediante una condensación aldólica convertirse en FBP.
- Bailey, P. S., & Bailey, C. A. (1998). Química orgánica: conceptos y aplicaciones. Ed. Pearson Educación.
- Devlin, T. M. (1992). Textbook of biochemistry: with clinical correlations. John Wiley & Sons, Inc.
- Garrett, R. H., & Grisham, C. M. (2008). Biochemistry. Ed. Thomson Brooks/Cole.
- Nelson, D. L., & Cox, M. M. (2006). Lehninger Principios de Bioquímica 4ª edición. Ed Omega. Barcelona.
- Rawn, J. D. (1989). Bioquímica (No. 577.1 RAW). Ed. Interamericana-McGraw-Hill
- Voet, D., & Voet, J. G. (2006). Bioquímica. Ed. Médica Panamericana.
