Buteno: qué es, propiedades, estructura química, usos
¿Qué es el buteno?
El buteno es el nombre que recibe una serie de cuatro isómeros con fórmula química C4H8. Son alquenos u olefinas, es decir, poseen un doble enlace C=C en su estructura. Además, son hidrocarburos, los cuales pueden encontrarse en yacimientos petroleros o ser originados mediante el craqueo térmico y obtener productos de menor peso molecular.
Los cuatro isómeros reaccionan con el oxígeno liberando calor y una llama de color amarillo. Asimismo, pueden reaccionar con un amplio espectro de moléculas pequeñas que se adicionan a su doble enlace.
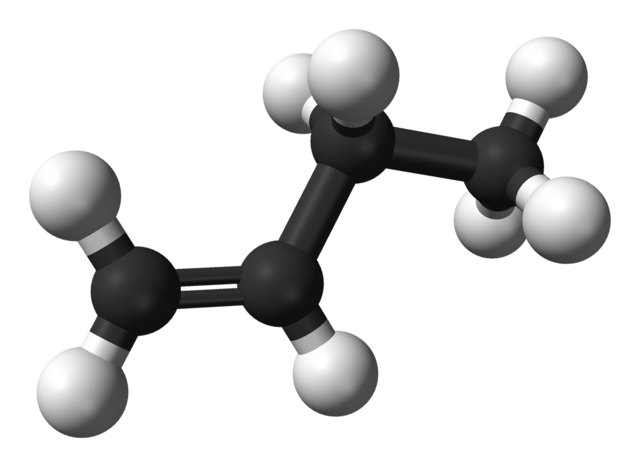
Pero, ¿cuáles son los isómeros del buteno? En la imagen superior se representa la estructura con esferas blancas (hidrógenos) y negras (carbonos) para el 1-Buteno. El 1-Buteno es el isómero más simple del hidrocarburo C4H8.
Nótese que hay ocho esferas blancas y cuatro esferas negras, lo cual concuerda con la fórmula química.
Los otros tres isómeros son cis y trans 2-Buteno, e iso-Buteno. Todos ellos exhiben propiedades químicas muy similares, aunque sus estructuras ocasionan variaciones en las propiedades físicas (puntos de fusión y ebullición, densidades, etc.).
Asimismo, sus espectros IR poseen patrones parecidos de bandas de absorción.
Coloquialmente, al 1-Buteno se le nombra como buteno, aunque 1-Buteno alude únicamente a un solo isómero y no a un nombre genérico. Estos cuatro compuestos orgánicos son gases, pero pueden licuarse a altas presiones o condensar (y hasta cristalizar) con un descenso de la temperatura.
Son fuente de calor y energía, reactivos para la síntesis de otros compuestos orgánicos y, sobre todo, necesarios para la fabricación del caucho artificial posterior a la síntesis del butadieno.
Propiedades físicas y químicas del buteno
Peso molecular
56.106 g/mol. Este peso es el mismo para todos los isómeros de la fórmula C4H8.
Aspectos físicos
Es un gas incoloro e inflamable (como los otros isómeros), y poseen un olor relativamente aromático.
Punto de ebullición
Los puntos de ebullición para los isómeros de buteno son los siguientes:
1-Buteno: -6º C
Cis-2-Buteno: 3.7º C
Trans-2-Buteno: 0.96º C
2-Metilpropeno: -6.9º C
Punto de fusión
1-Buteno: -185.3º C
Cis-2-Buteno: -138.9º C
Trans-2-Buteno: -105.5º C
2-Metilpropeno: -140.4º C
Solubilidad
El buteno es muy insoluble en agua debido a su naturaleza apolar. Sin embargo, se disuelve perfectamente en algunos alcoholes, como benceno, tolueno y éteres.
Densidad
0.577 a 25º C. Por lo tanto, es menos denso que el agua y en un recipiente se ubicaría por encima de la misma.
Reactividad
Como cualquier alqueno, su doble enlace es susceptible a adicionar moléculas u oxidarse. Esto hace que el buteno y sus isómeros sean reactivos. Por otro lado, son sustancias inflamables, por lo que ante un exceso de temperatura reaccionan con el oxígeno del aire.
Estructura química del buteno
En la imagen superior se representa la estructura del 1-Buteno. A su izquierda puede observarse la ubicación del doble enlace entre el primero y el segundo carbono.
La molécula tiene una estructura lineal, aunque la región en torno al enlace C=C es plana debido a la hibridación sp2 de estos carbonos.
Si se girara la molécula de 1-Buteno en un ángulo de 180º, se tendría la misma molécula sin cambios aparentes, por lo tanto, carece de actividad óptica.
¿Cómo interactuarían sus moléculas? Los enlaces C-H, C=C y C-C son de naturaleza apolar, por lo que ninguno de ellos colabora en la formación de un momento dipolar.
En consecuencia, las moléculas CH2=CHCH2CH3 deben interactuar mediante fuerzas de dispersión de London.
El extremo derecho del buteno forma dipolos instantáneos, que a corta distancia polariza los átomos adyacentes de una molécula vecina. Por su parte, el extremo izquierdo del enlace C=C, interactúa sobreponiendo las nubes π una encima de otra (como dos obleas o láminas).
Debido a que hay cuatro átomos de carbono componiendo el esqueleto molecular, sus interacciones apenas son suficientes para que la fase líquida tenga un punto de ebullición de -6º C.
Isómeros constitucionales y geométricos
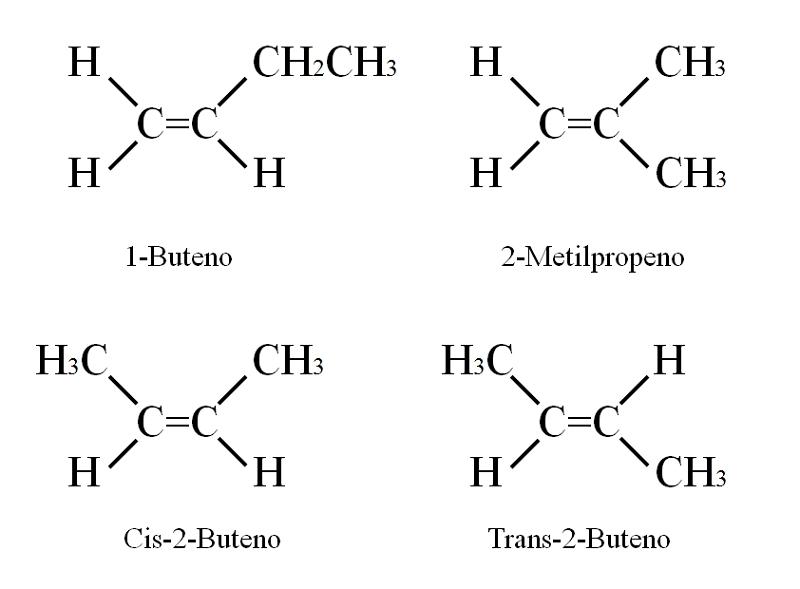
El 1-Buteno tiene por fórmula molecular C4H8; sin embargo, otros compuestos pueden tener en su estructura la misma proporción de átomos de C y H.
¿Cómo es posible? Si se observa detenidamente la estructura del 1-Buteno, los sustituyentes de los carbonos C=C pueden intercambiarse. Este intercambio produce otros compuestos a partir del mismo esqueleto.
Además, la posición del doble enlace entre el C-1 y C-2 puede desplazarse hacia el C-2 y C-3: CH3CH=CHCH3, 2-Buteno.
En el 2-Buteno los átomos de H pueden situarse en un mismo lado del doble enlace, el cual corresponde al estereoisómero cis; o en una orientación espacial opuesta, en el estereoisómero trans. Ambos constituyen lo que también se conoce como isómeros geométricos. Lo mismo aplica para los grupos –CH3.
Asimismo, nótese que si se dejara en la molécula de CH3CH=CHCH3 los átomos de H en un lado, y los grupos CH3 en otro, se obtendría un isómero constitucional: CH2=C(CH3)2, 2-Metilpropeno (también conocido como iso-buteno).
Estos cuatro compuestos poseen la misma fórmula C4H8 pero diferentes estructuras. 1-Buteno y 2-Metilpropeno son isómeros constitucionales; y cis y trans-2-Buteno, isómeros geométricos entre ellos dos (y constitucionales respecto al resto).
Estabilidad
Calor de combustión
De la imagen superior, ¿cuál de los cuatro isómeros representa la estructura más estable? La respuesta puede hallarse, por ejemplo, en los calores de combustión de cada uno de ellos.
Al reaccionar con el oxígeno, el isómero con fórmula C4H8 se transforma en CO2 liberando agua y calor:
C4H8(g) + 6O2(g) => 4CO2(g) + 4H2O(g)
La combustión es exotérmica, de manera que mientras más calor se libere, más inestable es el hidrocarburo. Por lo tanto, aquel de los cuatro isómeros que libere menos calor al arder en el aire, será el más estable.
Los calores de combustión para los cuatro isómeros son:
-1-Buteno: 2717 kJ/mol
-cis-2-Buteno: 2710 kJ/mol
-trans-2-Buteno: 2707 kJ/mol
-2-Metilpropeno: 2700 kJ/mol
Nótese que el 2-Metilpropeno es el isómero que desprende menos calor. Mientras que el 1-Buteno es el que libera más calor, lo cual se traduce en mayor inestabilidad.
Efecto estérico y electrónico
Esta diferencia de estabilidad entre los isómeros puede deducirse directamente a partir de la estructura química.
De acuerdo a los alquenos, aquel que posea más sustituyentes R adquiere mayor estabilización de su doble enlace. Así, el 1-Buteno es el más inestable porque apenas tiene un sustituyente (-CH2CH3); es decir, es monosustituido (RHC=CH2).
Los isómeros cis y trans del 2-Buteno difieren en energía debido a la tensión de Van der Wall originada por el efecto estérico.
En el isómero cis, los dos grupos CH3 en el mismo lado del doble enlace se repelen entre sí, mientras que en el isómero trans, estos se encuentran lo suficientemente alejados uno de otro.
Pero, ¿por qué entonces el 2-Metilpropeno es el isómero más estable? Porque intercede el efecto electrónico.
En este caso, a pesar de que es un alqueno disustituido, los dos grupos CH3 están en un mismo carbono; en posición geminal uno respecto al otro.
Estos grupos estabilizan al carbono del doble enlace cediéndole parte de su nube electrónica (ya que es relativamente más ácido por tener hibridación sp2).
Además, en el 2-Buteno sus dos isómeros solo poseen carbonos 2º; mientras que el 2-Metilpropeno contiene un carbono 3º, de mayor estabilidad electrónica.
Fuerzas intermoleculares
La estabilidad de los cuatro isómeros sigue un orden lógico, pero no ocurre lo mismo con las fuerzas intermoleculares. Si se comparan sus puntos de fusión y de ebullición, se encontrará que estos no obedecen el mismo orden.
Se esperaría que el trans-2-Buteno presentara las mayores fuerzas intermoleculares por tener mayor contacto superficial entre dos moléculas, a diferencia del cis-2-Buteno, cuyo esqueleto dibuja una C. Sin embargo, el cis-2-Buteno hierve a mayor temperatura (3.7º C), que el isómero trans (0.96º C).
Los puntos de ebullición similares para el 1-Buteno y 2-Metilpropeno cabría esperarlos porque estructuralmente son muy parecidos. No obstante, en el estado sólido la diferencia cambia radicalmente. El 1-Buteno funde a -185.3º C, mientras que el 2-Metilpropeno a -140.4º C.
Además, el isómero cis-2-Buteno funde a -138.9º C, a una temperatura muy cercana al 2-Metilpropeno, lo que puede significar que en el sólido presentan un arreglo igual de estables.
De estos datos puede concluirse que, a pesar de conocerse las estructuras más estables, estas no arrojan suficiente luz en el conocimiento de cómo las fuerzas intermoleculares operan en el líquido; y más aún, en la fase sólida de estos isómeros.
Usos del buteno
-Los butenos, dado su calor de combustión, pueden simplemente utilizarse como fuente de calor o combustibles. Así, se esperaría que la flama del 1-Buteno caliente más que la de los otros isómeros.
-Pueden emplearse como solventes orgánicos.
-Sirven como aditivos para elevar el nivel de octanaje de la gasolina.
-Dentro de la síntesis orgánica, el 1-Buteno participa en la producción de otros compuestos tales como: óxido de butileno, 2-glutanol, succinimida y terbutilmecaptano (usado para darle al gas de cocina su olor característico).
Asimismo, a partir de los isómeros de buteno se puede obtener butadieno (CH2=CH-CH=CH2), del cual se sintetiza el caucho artificial.
Más allá de estas síntesis, la diversidad de los productos dependerá de qué moléculas se adicionen al doble enlace.
Por ejemplo, se pueden sintetizar haluros de alquilo si se les hacen reaccionar con halógenos; alcoholes, si adicionan agua en medio ácido; y terc-butilésteres si adicionan alcoholes de bajo peso molecular (como el metanol).
Referencias
- Francis A. Carey. Química Orgánica. Ácidos carboxílicos (sexta edición, pág 863-866). Mc Graw Hill.
- Wikipedia (2018). Buteno. Tomado de: es.wikipedia.org
- YPF (Julio). Butenos. [PDF]. Tomado de: ypf.com
- William Reusch (2013). Addition Reactions of Alkenes. Recuperado de: 2.chemistry.msu.edu
- PubChem (2018). 1-Butene. Recuperado de: pubchem.ncbi.nlm.nih.gov
