¿Qué es un átomo neutro? (Con ejemplos)
Un átomo neutro es aquél que carece de carga eléctrica debido a una compensación entre el número de sus protones y electrones. Ambos son partículas subatómicas cargadas eléctricamente.
Los protones se encuentran aglomerados junto a los neutrones, y conforman el núcleo; mientras que los electrones se difuminan definiendo una nube electrónica. Cuando el número de protones en un átomo, igual a su número atómico (Z), iguala al número de electrones, se dice que hay una compensación entre las cargas eléctricas dentro del átomo.
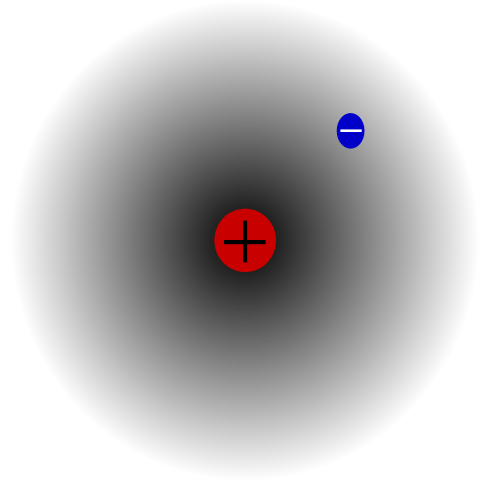
Se tiene por ejemplo un átomo de hidrógeno (imagen superior), el cual posee un protón y electrón. El protón se posiciona en el centro del átomo como su núcleo, mientras que el electrón orbita el espacio circundante, dejando regiones de menor densidad electrónica a medida que se aleja del núcleo.
Este es un átomo neutro debido a que se cumple que Z es igual al número de electrones (1p=1e). Si el átomo de H perdiera ese único protón, se encogería el radio atómico y prevalecería la carga del protón, convirtiéndose en el catión H+ (hidrón). Si, por otro lado, ganara un electrón, habría dos electrones y se convertiría en el anión H- (hidruro).
Índice del artículo
Para el ejemplo del átomo neutro de H, se vio que se cumple que el número de protones iguala al número de electrones (1p=1e); situación que no ocurre con los iones derivados por la pérdida o ganancia de un electrón.
Los iones se forman por un cambio en el número de electrones, ya sea debido a que el átomo los gane (-) o los pierda (+).
En el átomo del catión H+ predomina la carga de valencia del solitario protón frente a la ausencia total de un electrón (1p>0e). Esto es cierto para todos los demás átomos más pesados (np>ne) de la tabla periódica.
Aunque pueda parecer insignificante la presencia de una carga positiva, ella cambia diagonalmente las características del elemento en cuestión.
Por otro lado, en el átomo del anión H– predomina la carga negativa de los dos electrones frente al único protón del núcleo (1p2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Un ejemplo más conocido es el del sodio metálico. Su átomo neutro, Na, con Z=11, tiene 11 protones; por lo tanto, debe haber 11 electrones para compensar las cargas positivas (11p=11e).
El sodio por ser un elemento metálico, altamente electropositivo, pierde muy fácilmente sus electrones; en este caso, pierde solo uno, el de su capa de valencia (11p>10e). Así, se forma el catión Na+, el cual interacciona electrostáticamente con un anión; como el cloruro, Cl–, en la sal cloruro de sodio, NaCl.
El sodio metálico es venenoso y corrosivo, mientras que su catión está incluso presente dentro de las células. Esto demuestra cómo pueden variar drásticamente las propiedades de un elemento cuando gana o pierde electrones.
Por otro lado, el anión Na– (soduro, hipotéticamente) no existe; y de poder formarse, sería en extremo reactivo, ya que va en contra de la naturaleza química del sodio el ganar electrones. El Na– tendría 12 electrones, superando la carga positiva de su núcleo (11p12e).
Los átomos se enlazan covalentemente para dar origen a moléculas, a las cuales también puede denominárseles compuestos. Dentro de una molécula no puede haber iones aislados; en su lugar, hay átomos con cargas formales positivas o negativas. Estos átomos cargados inciden en la carga neta de la molécula, transformándola en un ion poliatómico.
Para que una molécula sea neutra la sumatoria de las cargas formales de sus átomos debe ser igual a cero; o, más sencillamente, todos sus átomos son neutros. Si los átomos que conforman una molécula son neutros, esta también lo será.
Por ejemplo, se tiene la molécula de agua, H2O. Sus dos átomos de H son neutros, al igual que el átomo de oxígeno. No pueden representarse del mismo modo como se muestra en la imagen del átomo de hidrógeno; ya que, si bien el núcleo no cambia, sí lo hace la nube electrónica.
El ion hidronio, H3O+, por otro lado, posee un átomo de oxígeno con carga parcial positiva. Esto quiere decir que en ese ion poliatómico pierde un electrón, y por tanto su número de protones es mayor que el de sus electrones.
El átomo neutro de oxígeno posee 8 protones y 8 electrones. Cuando gana dos electrones, forma lo que se conoce como anión óxido, O2-. En él, predominan las cargas negativas, habiendo un exceso de dos electrones (8p10e).
Los átomos neutros de oxígeno tienen una alta tendencia a reaccionar y unirse consigo mismo para formar O2. Es por esa razón que no hay átomos O “sueltos” por allí a su suerte y sin reaccionar con nada. Todas las reacciones conocidas para este gas se le adjudica al oxígeno molecular, O2.
El cobre tiene 29 protones y 29 electrones (además de neutrones). A diferencia del oxígeno, sus átomos neutros sí pueden hallarse en la naturaleza debido a su enlace metálico y una relativa estabilidad.
Al igual que el sodio, tiende a perder electrones en lugar de ganarlos. Dada su configuración electrónica y por otros aspectos, puede perder uno o dos electrones, convirtiéndose en los cationes cuproso, Cu+, o cúprico, Cu2+, respectivamente.
El catión Cu+ tiene un electrón menos (29p28e), y el Cu2+ ha perdido dos electrones (29p27e).
Los gases nobles (He, Ne, Ar, Kr, Xe, Rn), son uno de los pocos elementos que existen en forma de sus átomos neutros. Sus números atómicos son: 2, 10, 18, 36, 54 y 86, respectivamente. No ganan ni pierden electrones; aunque, el xenón, Xe, puede formar compuestos con el flúor y perder electrones.
Los metales si se les protege de la corrosión pueden mantener sus átomos neutrales, unidos por enlaces metálicos. En las aleaciones, soluciones sólidas de metales, los átomos permanecen (en su mayoría) neutros. En el latón, por ejemplo, hay átomos neutros de Cu y Zn.
- Jetser Carasco. (2016). What is a neutral atom? Recuperado de: introduction-to-physics.com
- Markings, Samuel. (25 de abril de 2017). Non Neutral Atoms Examples. Sciencing. Recuperado de: sciencing.com
- Chem4kids. (2018).Looking at Ions. Recuperado de: chem4kids.com
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
