Hipoclorito de sodio (NaClO): fórmula, síntesis, propiedades, usos
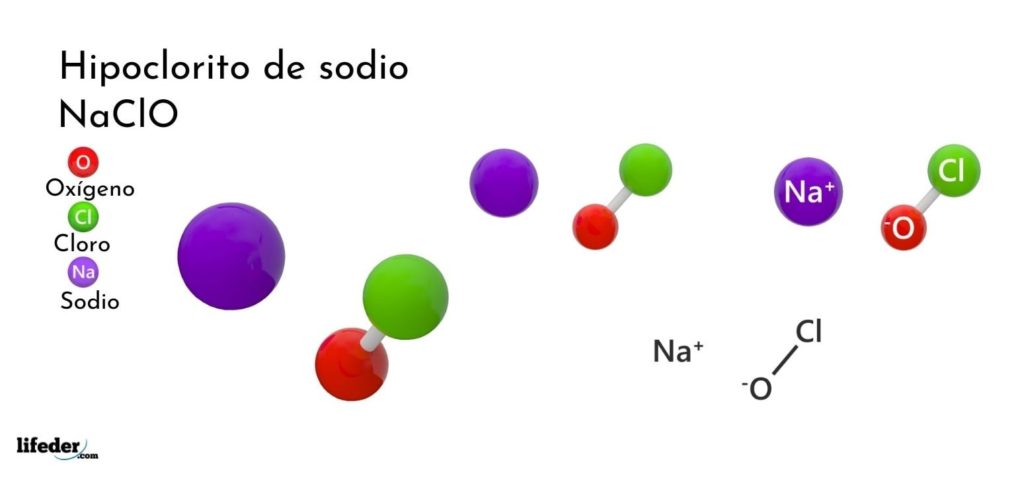
¿Qué es el hipoclorito de sodio?
El hipoclorito de sodio (NaClO) es una sal ternaria e inorgánica de sodio. Comercialmente se consigue como soluciones acuosas y es el agente activo de estos productos domésticos e industriales. Estas soluciones son conocidas con los nombres de blanqueador de cloro, blanqueador de soda, blanqueador líquido o, aún más refinado, licor de Javel.
En el agua el hipoclorito de sodio exhibe las mismas propiedades oxidantes del cloro gaseoso, por lo que una solución de esta sal equivale a portar dicho compuesto dentro de una botella plástica. De hecho, el cloro disponible en estos recipientes es un indicador de la concentración y el poder blanqueador de la solución de hipoclorito de sodio.
Esta sal ternaria en agua bien puede considerarse una simple solución acuosa de cloro; sin embargo, existen también otras formas disponibles, como la sólida en el caso del hipoclorito de calcio, y el cloro líquido. Las tres tienen el mismo poder oxidante y sus usos dependen de variables como la comodidad, el rendimiento o el tiempo.
Fórmula
La fórmula química del hipoclorito de sodio es NaClO. Está conformado por un catión Na+ y un anión ClO–. Los iones Na+ sienten atracción electrostática por los iones ClO–, estos últimos adoptando una estructura tetraédrica con una hibridación sp3.
La fórmula indica la proporción de los iones en el estado anhídrido, la cual es igual a 1:1. Sin embargo, esta aplica solo para el anhídrido.
En el caso del hipoclorito de sodio hidratado —una de las formas más estable para esta sal—, su fórmula química es NaClO·5H2O.
¿Dónde se encuentra el hipoclorito de sodio?
El NaClO es un producto sintético y, debido a su reactividad, solo se encuentra en regiones locales donde es utilizado, especialmente en las aguas residuales, suelos o incluso en emanaciones de agua potable.
En el cuerpo humano abundan los iones cloruros, los cuales podrían participar en reacciones redox que produzcan hipoclorito de sodio dentro del organismo.
Síntesis
A lo largo de la historia se ha preparado NaClO por varios métodos. El más simple consiste en una disolución de cloro en agua, o en soluciones de Na2CO3 que liberan CO2 por acción del ácido hipocloroso (HClO).
Otros métodos utilizan como materia prima la salmuera del mar a través de un proceso electrolítico. Bajo una eficiente agitación mecánica, el Cl2 y el NaOH generados por el NaCl y el agua reaccionan y se convierten en NaClO:
Cl2(g) + 2NaOH(aq) => NaClO + NaCl + H2O + Q(calor)
Hoy en día el proceso Hooker fabrica a grandes escalas este compuesto, el cual consiste en una versión mejorada del método anterior descrito.
Usos/aplicaciones del clorito de sodio

Las aplicaciones más comunes del hipoclorito de sodio son:
- El hipoclorito de sodio es utilizado como agente blanqueador en textiles, en los detergentes que lo incorporan y en la industria del papel.
- Su utilización como agente bactericida y desinfectante es muy amplia, utilizándose en la potabilización del agua y en el tratamiento de aguas residuales.
- Es conocida su utilidad en desinfectar los equipos utilizados en la preparación de alimentos y en el procesamiento de frutas y vegetales. Asimismo, se utiliza con la misma función desinfectante en la producción de setas, bovinos, cerdos y aves de corral.
- El hipoclorito de sodio se usa en la industria petrolera en la etapa de refinación.
- En el hogar se aprovecha la capacidad blanqueadora del hipoclorito de sodio en el lavado de la ropa blanca, y la acción desinfectante en la limpieza de los baños, pisos, etc.
- El hipoclorito de sodio se utiliza en la terapia de endodoncia, específicamente en el tratamiento de canal de la raíz del diente. En este tratamiento se utiliza la solución de Dakin (ClONa al 0,5 %) que preserva el tejido dental vital al disolver el tejido necrótico.
Propiedades del hipoclorito de sodio
Las soluciones de hipoclorito de sodio a temperatura ambiente son incoloras y tienen un olor dulce a cloro. Las propiedades físicas varían en función de las concentraciones de la sal disuelta en agua. Todas presentan coloraciones amarillas.
Mediante técnicas de cristalización, de estas soluciones se obtiene el sólido NaClO·5H2O, cuyos cristales son verdes-pálidos.
Esta sal hidratada tiene un peso molecular aproximado de 164 g/mol, una densidad de 1,11 g/mL, es muy soluble en agua y se descompone a 101 ºC. El NaClO·5H2O también es sensible a las mismas reacciones del anhídrido.
¿Por qué la sal es pentahidratada? Conforme el NaClO cristaliza en su entorno acuoso, las moléculas de agua envuelven los iones en una esfera acuosa.
Se puede pensar que tres de estas moléculas interaccionan con los pares de electrones no compartidos del Cl: una forma puente de hidrógeno con el O y la última es atraída por el Na.
Sin embargo, son los estudios enfocados a la estructura cristalina de este sólido los que tienen la verdadera respuesta a esta pregunta.
Equilibrio acuoso
El anión ClO– participa en el siguiente equilibrio de hidrólisis:
HClO(ac) + H2O(l) => ClO–(ac) + H+(ac)
Si aumenta la acidez de la solución, el equilibrio se desplaza hacia la izquierda, produciendo HClO.
Este ácido es aún más inestable que el hipoclorito y, por lo tanto, la descomposición disminuye la concentración del agente activo. Si el pH es básico (mayor a 11), garantiza la existencia del ClO– y el tiempo de vida del producto.
Sin embargo, una alcalinidad excesiva desencadena otros problemas en sus aplicaciones. Por ejemplo, una solución de NaClO muy básica daña la ropa en lugar de solo blanquearla.
Asimismo, en medio acuoso el HClO también se transforma en cloro, lo cual explica las coloraciones amarillas de estas soluciones:
HClO(ac) => Cl2(g) + H2O(l)
Desproporción
El átomo de cloro en el hipoclorito de sodio tiene un estado de oxidación de +1, necesitando solo de dos electrones para completar su octeto de valencia.
Por otro lado, su configuración electrónica es [Ne]3s23p5, pudiendo además vaciar todos los electrones de sus orbitales “p”, más energéticos.
Esto trae como consecuencia que el hipoclorito sufra reacciones de desproporción en iones con estados de oxidación de +1 y +5:
3ClO–(ac) => 2Cl–(ac) + ClO3–(ac)
Esta reacción en solución acuosa es acelerada con los incrementos de la temperatura y las concentraciones del hipoclorito. Igualmente, la reacción prosigue por un mecanismo distinto catalizado por la luz y óxidos metálicos de cobre, níquel y cobalto:
2NaOCl(aq) => O2(g) + 2NaCl(aq)
El NaClO anhídrido se desproporciona a una velocidad mucho más rápida, llegando incluso a explotar.
Agente oxidante
El átomo de cloro puede aceptar electrones de especies negativas (nucleofílicas). El anhídrido es un agente oxidante poderoso, reduciéndose en los aniones cloruros (Cl–).
En el caso del NaClO·5H2O, se piensa que las moléculas de agua impiden parcialmente que los ClO– sufran ataques nucleofílicos.
Sin embargo, dada la linealidad estructural del ClO–, estas moléculas de agua no ralentizan lo suficiente los “ataques” sobre el átomo de Cl. Es por esta razón que el hipoclorito de sodio es un agente oxidante fuerte.
Referencias
- Wikipedia. (2018). Sodium hypochlorite. Recuperado el 07 de abril de 2018, de: en.wikipedia.org
- Francisco J. Arnaiz. (2016). Experimentos para el Laboratorio de Química Inorgánica Verde. Departamento de química, Universidad de Burgos, España.
- Chemical Book. (2017). Sodium hypochlorite. Recuperado el 07 de abril de 2018, de: chemicalbook.com
- Brian Clegg. (09 de marzo de 2016). Sodium hypochlorite. Recuperado el 07 de abril de 2018, de: chemistryworld.com
- OxyChem. (Diciembre de 2014). Sodium Hypochlorite Handbook. Recuperado el 07 de abril de 2018, de: oxy.com
- PubChem. (2018). Sodium Hypochlorite. Recuperado el 07 de abril de 2018, de: pubchem.ncbi.nlm.nih.gov.
