Amidas: características, estructura, tipos, ejemplos
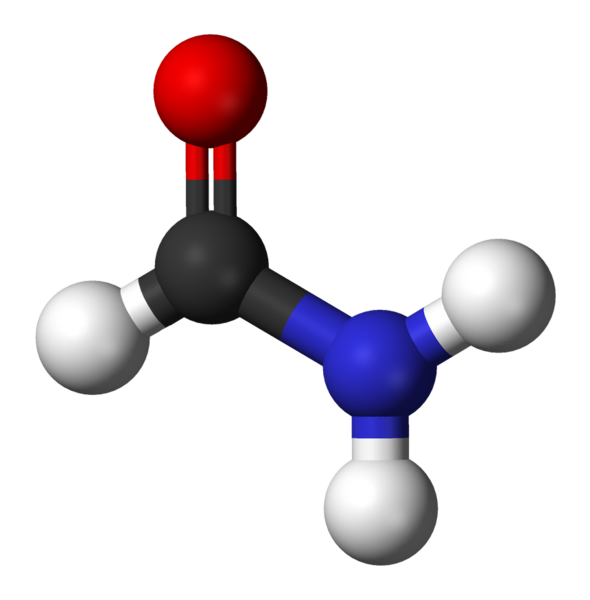
¿Qué son las amidas?
Las amidas son un tipo de compuestos orgánicos que se forman por la unión entre un ácido carboxílico y una amina. También se les llama aminas ácidas y de allí es precisamente de donde viene la palabra amida.
Estos compuestos son muy importantes para la vida, ya que forman parte esencial de las proteínas, de los péptidos y de algunas hormonas. También forman parte de las bases nitrogenadas del ADN y del ARN, los cuales contienen nuestra información genética.
Las amidas también son muy importantes en la industria. Por ejemplo, el nylon es una de las fibras sintéticas más utilizadas en todo el mundo y está formado por una cadena larga de amidas unidas una después de otra.
También, las amidas se utilizan mucho en la industria farmacéutica, ya que forman parte de medicamentos tales como la lidocaína.
Características de las amidas
- Casi todas son sólidas: todas las amidas son sólidas a temperatura ambiente, excepto la más pequeña y simple que es la formamida. Esta última es líquida.
- Tienen alto punto de ebullición: comparadas con los ácidos carboxílicos y con las aminas de las cuales están hechas, las amidas tienen un punto de ebullición alto. Por ejemplo, la acetamida (CH3CONH2) está formada por la unión del ácido acético (vinagre) con el amoníaco. El punto de ebullición de la acetamida es de 221,2 ºC, mientras que el del ácido acético es de 118 ºC y el del amoníaco es de -33,34 ºC.
- Algunas son solubles en agua: las amidas más pequeñas se mezclan bien con el agua, así que es fácil disolverlas en ella. Sin embargo, a medida que se vuelven más grandes, se van tornando menos solubles.
- Son menos básicas que las aminas: una amida siempre es menos básica (o más ácida) que la amina de la cual proviene. De hecho, el nombre amida viene de combinar amina+ácida.
- Su enlace se rompe fácilmente: si se les agrega una base fuerte como catalizador, las amidas reaccionan rápidamente con agua. Esta reacción se llama hidrólisis y durante la misma, la amida se rompe para formar el ácido y la amina originales.
- Son incoloras e inodoras: en general, las amidas son sustancias que no poseen ni un color ni un olor característico.
Estructura del grupo funcional
Químicamente, la amida es un grupo funcional que contiene un grupo carbonilo (C=O) proveniente de un ácido carboxílico, enlazado a un nitrógeno proveniente del amoníaco o de una amina. La estructura general de las amidas es:
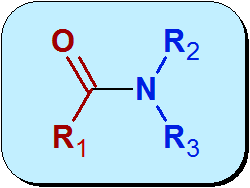
Una característica de la estructura de las amidas que las distingue de las aminas, es que el par de electrones libres que posee el nitrógeno lo comparte con el grupo carbonilo por medio de un proceso que se llama resonancia. Esto es lo que hace que las amidas sean menos básicas que las aminas.
Tipos de amidas
Dependiendo de si el ácido se combina con el amoníaco, con una amina primaria o con una amina secundaria, se pueden obtener tres tipos de amidas con estructuras diferentes:
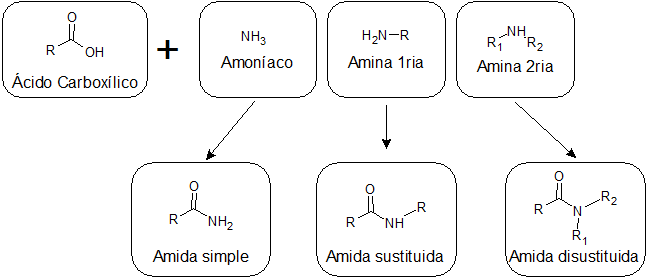
Amidas simples
Se forman por la unión entre un ácido carboxílico y el amoníaco. Este tipo de amida tiene un grupo –NH2 enlazado al grupo carbonilo. Las amidas simples pueden formar varios enlaces de hidrógeno entre sí y con el agua, por lo que suelen ser más solubles que las sustituidas.
- Ejemplos de amida simples: la formamida, la acetamida y la butiramida.
Amidas sustituidas
Se obtienen por la unión de un ácido y una amina primaria. En este caso, uno de los hidrógenos del –NH2 de las amidas simples es sustituido por un alquilo, y por eso se les dice amidas sustituidas.
- Ejemplo de una amida sustituida: el enlace entre los aminoácidos en las proteínas.
Amidas disustituidas
Provienen de la reacción entre un ácido y una amina secundaria. En este caso, ambos hidrógenos del grupo –NH2 son sustituidos por grupos alquilo. Las amidas disustituidas no tienen hidrógenos unidos a nitrógenos, por lo que no pueden formar puentes de hidrógeno entre sí, y solo uno débil con el agua. Esto las hace menos solubles en agua que las demás clases de amidas.
Lactamas, amidas primarias, secundarias y terciarias
A parte de los tres tipos de amidas recién mencionadas, también existen amidas primarias, secundarias y terciarias, que se diferencian por tener uno, dos o tres grupos acilo unidos al átomo de nitrógeno.
Finalmente, algunas amidas forman ciclos cerrados. En este caso, el compuesto recibe el nombre de lactama. Las lactamas son muy importantes en la naturaleza. Por ejemplo, el uracilo que forma parte del ARN, es una lactama.
Nomenclatura de las amidas
Amidas simples
Las amidas simples se nombran a partir del nombre de la cadena de carbonos del ácido del que provienen (la cadena principal). El nombre se construye colocando el prefijo que indica el número de carbonos (metan-, butan-, hexan-, etc.) o el nombre común del ácido quitando la terminación –oico o –ico (como en acético) y añadiendo la terminación –amida.
- Ejemplo: la amida que proviene del ácido acético, se llama acetamida y la que viene del ácido propanóico se llama propanamida.
Amidas sustituidas y disustituidas
En este caso, se comienza nombrando los grupos alquilo que se encuentran unidos al nitrógeno, precedidos por la letra N-. Luego se nombra el resto de la amida como cadena principal.
Ejemplo:
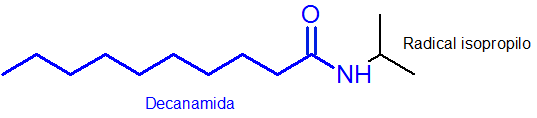
El resto de la cadena principal, la que tiene el grupo funcional amida, tiene 10 átomos de carbono. Es decir, que su nombre debe tener el prefijo decan- seguido de la terminación amida, o, decanamida. Entonces, el nombre completo es N-isopropildecanamida.
Ejemplos de amidas
- Benzamida C6H5CONH2
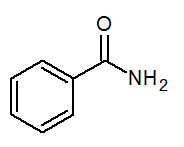
- N,N-dimetilacetamida CH3CON(CH3)2
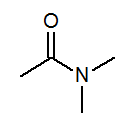
- Acetamida CH3CONH2
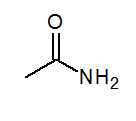
- Fenilacetamida (C6H5)CH2CONH2
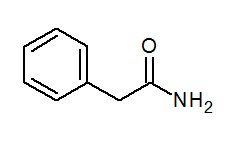
- N-butil-N-propilformamida HCON(C3H7)(C4H9)
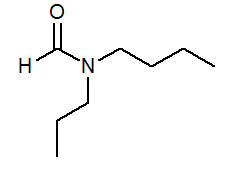
- 4-hidroxibutanamida CH2(OH)CH2CH2CONH2
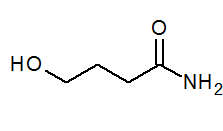
- Urea CO(NH2)2
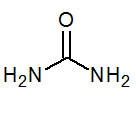
- Propanamida CH3CH2CONH3
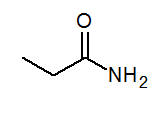
- N-butil-2-isopropilpentanamida CH3CH2CH2CH(C3H7)CONH(C4H9)

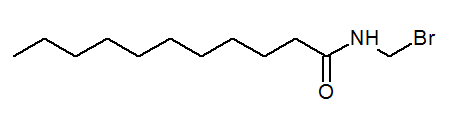
- N-(bromometil)undecanamida CH3(CH2)9CONHCH2Br
Referencias
- Britannica, T. Editors of Encyclopaedia (2019, May 15). Amide. Encyclopedia Britannica. Tomado de britannica.com
- Amides- Structures and Names. (2020, August 17). Tomado de chem.libretexts.org
- Carey, F. A. (2008). Organic chemistry. Boston: McGraw-Hill Higher Education.
- Smith, M., March, J., & March, J. (2001). March’s advanced organic chemistry: Reactions, mechanisms, and structure. New York: Wiley.
- Zabicky, J. (1970). The Chemistry of the Amides, Part 1. New York: Wiley
