Butanal: estructura, propiedades, usos y riesgos
El butanal es un aldehído de cadena abierta, constituido por cuatro átomos de carbono, y es análogo al butano; es de hecho la segunda forma más oxidada del hidrocarburo butano después del ácido butírico. Su fórmula molecular es CH3CH2CH2CHO, donde –CHO es el grupo formilo.
Este aldehído, uno de los más livianos, consiste de un líquido transparente, inflamable y menos denso que el agua. Además, es soluble en el agua y miscible con la mayoría de los solventes orgánicos; por lo tanto, puede utilizarse para tener mezclas orgánicas de una sola fase.
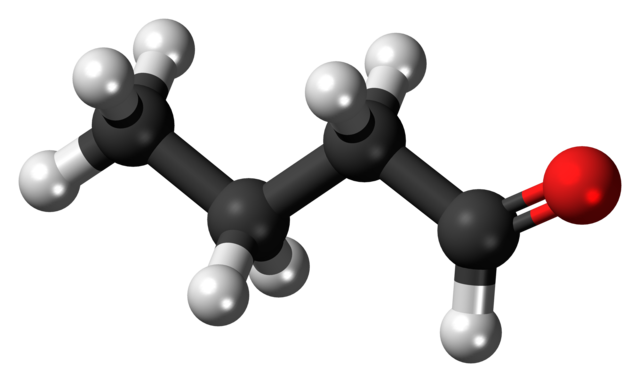
La presencia del grupo carbonilo (el de la esfera roja, imagen superior) le confiere polaridad química a la molécula de butanal, y por tanto la capacidad de experimentar la interacción dipolo-dipolo entre sus moléculas; aunque no se forman puentes de hidrógeno entre ellas.
Esto trae como consecuencia que el butanal presente puntos de ebullición y fusión mayores que el butano, pero menores a los presentados por el alcohol n-butílico.
El butanal es usado como disolvente y es intermediario para la obtención de numerosos productos; tales como aceleradores de la vulcanización de los cauchos, resinas, productos farmacéuticos y agroquímicos.
El butanal es un compuesto tóxico que por inhalación puede producir inflamación de las vías respiratorias superiores, los bronquios y edema pulmonar que, inclusive, puede tener consecuencias fatales.
Índice del artículo
- 1 Estructura del butanal
- 2 Propiedades
- 2.1 Nombres químicos
- 2.2 Fórmula molecular
- 2.3 Aspecto físico
- 2.4 Olor
- 2.5 Punto de ebullición
- 2.6 Punto de fusión
- 2.7 Punto de ignición
- 2.8 Solubilidad en agua
- 2.9 Solubilidad en solventes orgánicos
- 2.10 Densidad
- 2.11 Densidad de vapor
- 2.12 Presión de vapor
- 2.13 Auto-ignición
- 2.14 Viscosidad
- 2.15 Calor de combustión
- 2.16 Calor de vaporización
- 2.17 Tensión superficial
- 2.18 Umbral de olor
- 2.19 Índice de refracción
- 2.20 Momento dipolar
- 2.21 Longitudes de onda (λ) de absorción máxima en agua
- 2.22 Polimerización
- 2.23 Reactividad
- 2.24 Condensación aldólica
- 3 Síntesis
- 4 Usos
- 5 Riesgos
- 6 Referencias
Acaba de mencionarse que el grupo formilo, -CHO, le confiere polaridad a la molécula de butanal o butiraldehído debido a la mayor electronegatividad del átomo de oxígeno. Como resultado de esto, sus moléculas pueden interactuar unas con otras mediante fuerzas dipolo-dipolo.
En la imagen superior se muestra, con un modelo de esferas y barras, que la molécula de butanal tiene una estructura lineal. El carbono del grupo –CHO tiene hibridación sp2, mientras que los carbonos restantes hibridación sp3.
No solo eso, sino que además es flexible, y sus enlaces pueden rotar sobre sus propios ejes; y así, se generan distintas conformaciones o confórmeros (mismo compuesto, pero con sus enlaces rotados).
La siguiente imagen explica mejor este punto:

El primer confórmero (el superior) corresponde a la molécula de la primera imagen: el grupo metilo de la izquierda, -CH3, y el grupo -CHO, están en posiciones anti paralelo entre sí; uno apunta hacia arriba, y el otro hacia abajo, respectivamente.
Mientras, el segundo confórmero (el inferior) corresponde a la molécula con el -CH3 y el -CHO en posiciones eclipsadas; esto es, ambas apuntan en la misma dirección.
Ambos confórmeros son rápidamente intercambiables, y por tanto la molécula de butanal anda rotando y vibrando constantemente; y sumado el hecho de que posee un dipolo permanente, esto permite que sus interacciones sean lo suficiente fuertes para hervir a 74,8ºC.
-Butanal
-Butiraldehido
-1-Butanal
-Butiral
-N-Butiraldehido.
C4H8O o CH3CH2CH2CHO.
Es un líquido claro, transparente.
Olor característico, acre, aldehído.
167 ºF a 760 mmHg (74,8 ºC).
-146 ºF (-96,86 ºC).
-8 ºF (-22 ºC) vaso cerrado.
7 g/100 mL a 25 ºC.
Miscible con etanol, éter, acetato de etilo, acetona, tolueno y muchos otros solventes orgánicos.
0,803 g/cm3 a 68 ºF.
2,5 (en relación al aire tomado igual a 1).
111 mmHg a 25 ºC.
446 ºF. 425 ºF (21,8 ºC).
0,45 cPoise a 20 ºC.
2479,34 kJ/mol a 25 ºC.
33,68 kJ/mol a 25 ºC.
29,9 dina/cm a 24 ºC.
0,009 ppm.
1,3843 a 20 ºC.
2,72 D.
225 nm y 282 nm (luz ultravioleta).
El butanal puede polimerizarse en contacto con álcalis o ácido, siendo la polimerización peligrosa.
Cuando se expone al aire se oxida, formando el ácido butírico. A una temperatura de 230ºC, el butanal se inflama espontáneamente con el aire.
Dos moléculas de butanal pueden reaccionar entre sí, en presencia de KOH y una temperatura de 6-8 ºC, para formar el compuesto 2-etil-3-hidroxihexanol. Este tipo compuesto se denominan aldol, ya que posee en su estructura un grupo aldehído y un grupo alcohólico.
El butanal se puede producir por la deshidrogenación catalítica del alcohol n-butilico; la hidrogenación catalítica del crotonaldehido; y la hidroformilación del propileno.
-El butanal es un disolvente industrial, pero además, es intermediario en la síntesis de otros disolventes; por ejemplo 2-etilhexanol, n-butanol y trimetilpropano.
-También se utiliza como intermediario en la elaboración de resinas sintéticas, entre ellas, el polivinil butiral; aceleradores de la vulcanización del caucho; fabricación de productos farmacéuticos; productos para la protección de los cultivos; pesticidas; antioxidantes; auxiliares de bronceados.
-El butanal es utilizado como materia prima para la elaboración de aromas sintéticos. Además, se emplea como agente saborizante de alimentos.
-En el hombre, el butanal es utilizado como un biomarcador indicativo del daño por oxidación, experimentado por los lípidos, las proteínas y los ácidos nucleícos.
-Se usó en forma experimental, conjuntamente con la formalina y glutardehido, para tratar de disminuir el reblandecimiento que experimentan los cascos del ganado vacuno, por la exposición al agua, la orina y las heces del propio ganado. Los resultados experimentales resultaron positivos.
El butanal es destructivo para las membranas del tejido mucoso del tracto respiratorio superior, así como para los tejidos de la piel y los ojos.
Por contacto con la piel produce enrojecimiento y quemaduras. En los ojos, se producen las mismas lesiones, acompañadas de dolor y daño en el tejido ocular.
La inhalación de butanal puede tener consecuencias graves, ya que puede producir en la laringe y en los bronquios inflamación y edema; mientras que en los pulmones, produce una neumonía química y edema pulmonar.
Los signos de sobreexposición comprenden: sensaciones de ardor en las vías respiratorias superiores, tos, sibilancias, es decir, emisión de silbido al respirar; laringitis, falta de aliento, dolor de cabeza, náuseas y también vómitos.
La inhalación puede ser fatal como resultado del espasmo de las vías repiratorias.
La ingestión de butanal provoca una sensación de “quemazón” en las vías digestivas: cavidad bucal, faringe, esófago y estómago.
- Morrison, R. T. y Boyd, R. N. (1987). Química Orgánica. (5ta Edición.). Editorial Addison-Wesley Iberoamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- PubChem. (2019). Butanal. Recuperado de: pubchem.ncbi.nim.nih.guv
- Wikipedia. (2019). Butanal. Recuperado de: es.wikipedia.org
- Chemical Book. (2017). Butanal. Recuperado de: chemicalbook.com
- Basf. (Mayo de 2017). N-Butyraldehyde. [PDF]. Recuperado de: solvents.basf.com
