Acetilcolinesterasa: estructura, funciones e inhibidores
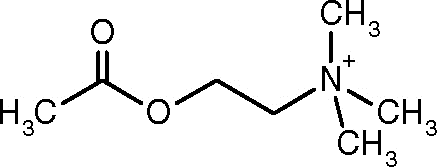
La acetilcolinesterasa (acetilcolina acetil hidrolasa, EC 3.1.1.7) es una enzima que se encuentra principalmente en el sistema nervioso central. Su tarea, tal y como el nombre lo indica, es el procesamiento hidrolítico del neurotransmisor acetilcolina.
Es una enzima asociada con la membrana celular que funciona junto con el receptor de la acetilcolina para mediar la excitación de las células postsinápticas y cuyo mecanismo catalítico es sorprendentemente veloz.
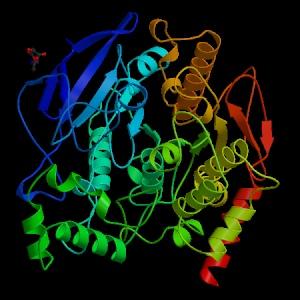
Desde el punto de vista mecánico, esta enzima puede ser vista como una serín-hidrolasa, y en el dominio catalítico de su sitio activo contiene la triada de aminoácidos característica de las serín proteasas: serina, histidina y un residuo acídico. Sin embargo, el residuo acídico es un glutamato, mientras que las serín proteasas poseen normalmente un aspartato.
Una de las primeras observaciones que ligó la actividad catalítica de la acetilcolinesterasa con los tejidos nerviosos colinérgicos y tejidos musculares fue la realizada por Dale en el año 1914; posteriormente se ha determinado que también está presente en neuronas no-colinérgicas y en células hematopoyéticas, osteogénicas y neoplásicas.
Gracias al estudio de diversos organismos, actualmente se sabe que la enzima está presente en la membrana de diferentes tipos de células como los eritrocitos, células nerviosas y musculares, órganos eléctricos y otras.
Índice del artículo
En condiciones naturales o “in vivo”, la acetilcolinesterasa es una enzima polimórfica que se compone de varias subunidades catalíticas de más o menos 80 kDa, que se ensamblan para formar una estructura oligomérica (de varias subunidades).
La cantidad y complejidad de estas subunidades depende del tipo celular y de la especie que se considere.
Algunas de las formas enzimáticas más complejas presentan subunidades catalíticas con formas globulares (G) o asimétricas (A) unidas mediante puentes disulfuro. Los puentes disulfuro son enlaces covalentes formados entre dos moléculas de azufre de los grupos tiol (-SH) de dos residuos del aminoácido cisteína.
Cada subunidad G contiene un solo sitio activo, mientras que las subunidades A, por lo general, se caracterizan por presentar tres dominios estructurales, a saber: las subunidades catalíticas, unas colas tipo colágeno ricas en residuos de glicina, hidroxiprolina e hidroxilisina, y otras colas no-colagénicas (diferentes al colágeno).
Las formas asimétricas de la acetilcolinesterasa se conocen como A12, A8 y A4, que tienen 12, 8 y 4 subunidades catalíticas, respectivamente.
Generalmente, los residuos del dominio catalítico en el sitio activo se encuentran en una región “profunda” de las subunidades, lo que podría verse como contradictorio respecto a la rápida velocidad de la reacción que cataliza esta enzima y la aparente inaccesibilidad del sustrato a estos sitios.
Sin importar el polimorfismo de la enzima, tanto las subunidades globulares como las asimétricas tienen actividades catalíticas similares.
Variantes
Algunas células diferentes a las células nerviosas, tal y como los eritrocitos, producen enzimas acetilcolinesterasas predominantemente globulares, diméricas y asociadas en su mayoría con la cara externa de la membrana plasmática.
La enzima de los eritrocitos, aunque de menor complejidad estructural, es también una enzima anfipática, cuyo dominio catalítico activo se encuentra en la gran región hidrofílica, mientras que el dominio hidrofóbico, que contiene la región carboxilo terminal, se encarga de sostenerla en la membrana.
Mucho del conocimiento actual acerca de la secuencia de la acetilcolinesterasa surgió del estudio de la enzima de Torpedo californica, un pez raya que habita en el océano Pacífico y que ha sido empleado tradicionalmente como organismo modelo para el estudio de diferentes proteínas del sistema nervioso.
Las subunidades de la acetilcolinesterasa son sintetizadas como pro-proteínas que luego son procesadas para dar lugar a subunidades maduras. Cada subunidad consiste en un polipéptido de cerca de 575 aminoácidos y 65 kDa de peso molecular, que aumenta por la adición de un 7-8% de residuos carbohidratados (glicosilación).
La actividad catalítica del sitio activo de las subunidades está determinada por un residuo de serina en la posición 200, que se encuentra en una región “profunda” de las subunidades catalíticas.
Diferentes variantes o isoformas de la enzima existen en los organismos gracias a distintos sitios para el “splicing alternativo” de los pre-ARN mensajeros en ambos de sus extremos (5’ y 3’). La secuencia carboxilo-terminal de la isoforma de cada subunidad es la que determina el ensamblaje de los oligómeros entre sí.
La acetilcolinesterasa es una enzima con múltiples funciones biológicas no necesariamente relacionadas entre sí. Hecho atestiguado por su expresión diferencial durante la embriogénesis, la extensión neural embrionaria, el desarrollo muscular y la sinaptogénesis.
Como se ha destacado anteriormente, tiene una importante función en la hidrólisis rápida de la acetilcolina y por lo tanto en la regulación de su efecto en el espacio sináptico neuromuscular o en los espacios sinápticos colinérgicos del sistema nervioso central.
Un ejemplo de sus funciones es la contracción del músculo esquelético, que se da gracias a un tipo de sinapsis química conocida como placa motora, ubicada entre una neurona motora y una fibra muscular.
En esta sinapsis se consiguen cientos de vesículas cargadas con acetilcolina, que son liberadas desde la neurona motora para la propagación de un impulso eléctrico.
Este proceso de neurotransmisión es bastante complejo, no obstante, la participación de la acetilcolinesterasa es crucial para la terminación de la transmisión sináptica que depende del neurotransmisor acetilcolina, puesto que este debe ser degradado y luego debe difundir fuera de la hendidura sináptica para culminar con la excitación de la membrana.
Así, la enzima acetilcolinesterasa se encarga de regular la concentración de este transmisor en la sinapsis neuromotora.
Otras funciones “no clásicas” de la enzima se relacionan con la neuritogénesis o crecimiento de células nerviosas; con los procesos de adhesión celular, sinaptogénesis, activación de neuronas-dopamina en la sustancia negra del mesencéfalo, procesos hematopoyéticos y trombo poiéticos, entre otras.
Los inhibidores de la acetilcolinesterasa funcionan impidiendo que esta hidrolice a la acetilcolina, incrementando, con ello, el nivel y la duración de la acción de este neurotransmisor. Pueden clasificarse, según su mecanismo de acción, como reversibles e irreversibles.
Son aquellos que inhiben irreversiblemente la actividad hidrolítica de la acetilcolinesterasa por su unión covalente al residuo de serina en el sitio activo de la enzima. Este grupo está compuesto principalmente por los organofosforados.
En general, estos son compuestos activos presentes en muchos insecticidas y son los responsables de gran cantidad de muertes accidentales por envenenamiento. Son ésteres o tioles derivados del ácido fosfórico, fosfónico, fosfínico o fosforamídico.
El sarín, tabun, soman y ciclosarin se encuentran entre los compuestos más tóxicos sintetizados por el hombre puesto que pueden matar a un ser humano al inducir fallas respiratorias y circulatorias por bloqueo de la acetilcolinesterasa en el sistema nervioso periférico.
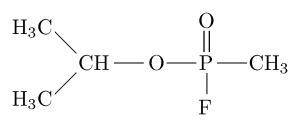
El sarín, por ejemplo, es un “gas nervioso” que ha sido utilizado como arma química de uso terrorista.
Este orden de la clasificación agrupa inhibidores competitivos y no competitivos que funcionan mediante la carbamilación transitoria y reversible de un residuo de serina en el sitio activo y muchos han sido sintetizados y purificados a partir de fuentes vegetales o fúngicas.
Los carbamatos como la fisostigmina y la neostigmina son inhibidores reversibles que se emplean como fármacos para el tratamiento de enfermedades como el glaucoma y la miastenia gravis, respectivamente.
Otros agentes terapéuticos de este grupo también se emplean para el tratamiento de la enfermedad de Alzheimer, el Parkinson, obstrucciones intestinales post-operatorias (íleo post-operatorio), distensión de la vejiga y como antídotos para la sobredosis con anticolinérgicos.
Un mecanismo natural interesante contra algunas sustancias inhibidoras de la acetilcolinesterasa tiene que ver con la participación de una enzima menos específica conocida como butirilcolinesterasa.
Esta enzima también es capaz de hidrolizar la acetilcolina y al mismo tiempo puede actuar como un señuelo molecular que reacciona con estas toxinas antes de que ejerzan su efecto negativo sobre la acetilcolinesterasa.
Se ha demostrado que la acetilcolinesterasa forma un complejo estable con los componentes de las placas seniles características de la patología. Además, algunos patrones alterados de glicosilación de esta enzima han sido relacionados con la presencia y la formación de las placas amiloideas en el cerebro.
Muchos de los inhibidores reversibles de la acetilcolinesterasa, por tanto, han sido empleados como fármacos de primera generación para el tratamiento de esta enfermedad y de otras condiciones neurodegenerativas relacionadas. Entre ellos están el donepezilo, la rivastigmina y la galantamina.
- Dvir, H., Silman, I., Harel, M., Rosenberry, T. L., & Sussman, J. L. (2010). Acetylcholinesterase: From 3D structure to function. Chemico-Biological Interactions, 187, 10–22.
- Houghton, P., Ren, Y., & Howes, M. (2006). Acetylcholinesterase inhibitors from plants and fungi. Natural Product Reports, 23, 181–199.
- Krsti, D. Z., Lazarevi, T. D., Bond, A. M., & Vasi, V. M. (2013). Acetylcholinesterase Inhibitors: Pharmacology and Toxicology. Current Neuropharmacology, 11, 315–335.
- Mukherjee, P. K., Kumar, V., Mal, M., & Houghton, P. J. (2007). Acetylcholinesterase inhibitors from plants. Phytomedicine, 14, 289–300.
- Quinn, D. M. (1987). Acetylcholinesterase: Enzyme Structure, Reaction Dynamics, and Virtual Transition States. Chem. Rev., 87, 955–979.
- Racchi, M., Mazzucchelli, M., Porrello, E., Lanni, C., & Govoni, S. (2004). Acetylcholinesterase inhibitors: novel activities of old molecules. Pharmacological Research, 50, 441–451.
- Rosenberry, T. (1975). Acetylcholinesterase. Advances in Enzymology and Related Areas of Molecular Biology, 43, 103–218.
- Soreq, H., & Seidman, S. (2001). Acetylcholinesterase — new roles for an old actor. Nature Reviews, 2, 294–302.
- Talesa, V. N. (2001). Acetylcholinesterase in Alzheimer’s disease. Mechanisms of Ageing and Development, 122, 1961–1969.
