Métodos de separación de mezclas homogéneas
Los métodos de separación de mezclas homogéneas son todos aquellos que, sin hacer uso de reacciones químicas, permiten obtener los componentes o solutos que integran una misma fase; es decir, de un líquido, sólido o gas.
Tales mezclas homogéneas consisten de soluciones, en las cuales las partículas de soluto son demasiado pequeñas para poder distinguirlas a simple vista. Son tan pequeñas, que no existen filtros lo suficiente estrechos o selectivos para retenerlas mientras la solución los traspasa. Tampoco ayuda para su separación técnicas como la centrifugación o la magnetización.
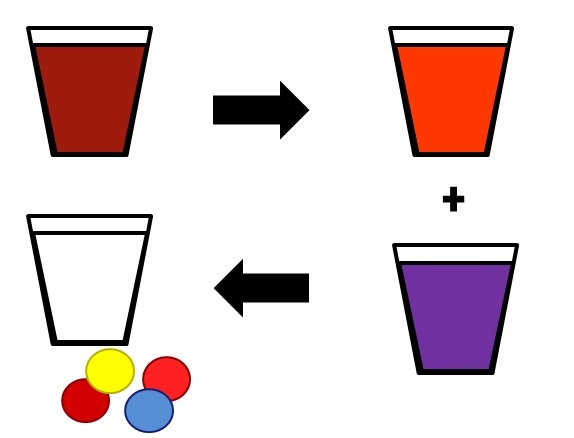
Arriba se muestra un ejemplo de cómo las soluciones van separándose en sus componentes. La mezcla inicial (marrón), se separa en dos componentes, igual de homogéneos (anaranjado y morado). Finalmente, de las dos mezclas resultantes se obtiene el solvente (blanco) y los cuatro respectivos pares de solutos (rojo-amarillo y rojo-azul).
Entre los métodos o técnicas de separación de soluciones tenemos la evaporación, destilación, cromatografía y cristalización fraccionada. Dependiendo de la complejidad de la mezcla, es probable que deba utilizarse más de uno de estos métodos hasta romper con la homogeneidad.
Índice del artículo

Las mezclas homogéneas más simples son las soluciones donde se han disuelto un solo soluto. Por ejemplo, en la imagen superior se tiene una solución colorida debido a la absorción y reflexión de la luz visible con las partículas de su soluto.
Si se ha agitado bien durante su preparación, no habrá regiones más clara u oscuras que otras; todas son iguales, uniformes. Dichas partículas coloridas no pueden separarse del solvente por ningún método mecánico, por lo que necesitará de energía en forma de calor (triángulo rojo) para lograrlo.
Así, la solución colorida se calienta a cielo abierto para acelerar y permitir la evaporación del solvente fuera de su recipiente. A medida que esto sucede, el volumen que separa las partículas de soluto disminuye y, por lo tanto, sus interacciones aumentan y terminan lentamente sedimentando.
El resultado final es que el soluto colorido permanece en el fondo del recipiente y el solvente se ha evaporado por completo.
El inconveniente con la evaporación es que, más que separar solutos, su objetivo es el de eliminar el solvente calentándolo hasta su punto de ebullición. El sólido remanente puede estar compuesto por más de un soluto y se requiere por lo tanto de otros métodos de separación para definirlo en sus componentes aislados.
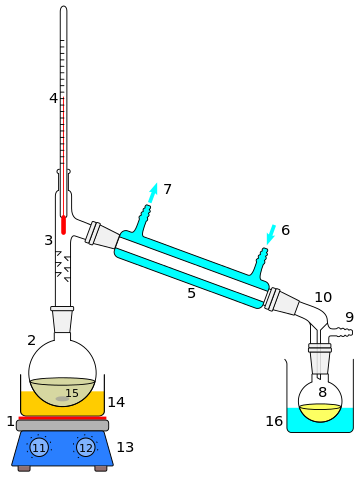
La destilación es quizás el método de separación de soluciones o mezclas homogéneas más utilizado. Su uso se extiende a sales o metales fundidos, gases condensados, mezclas de solventes, o extractos orgánicos. El soluto es en la mayoría de las veces un líquido, cuyo punto de ebullición difiere en varios grados respecto al del solvente.
Cuando la diferencia entre tales puntos de ebullición es alta (mayor de 70 ºC), se recurre a la destilación simple; y si no, entonces se realiza una destilación fraccionada. Ambas destilaciones poseen múltiples montajes o diseños, así como una metodología distinta para mezclas de distinta naturaleza química (volátiles, reactivas, polares, apolares, etc.).
En la destilación tanto el solvente como los solutos se conservan, y esta es una de sus principales diferencias respecto a la evaporación.
Sin embargo, la rotaevaporación combina estos dos aspectos: una mezcla líquido-sólido o líquido-líquido, como la de un aceite disuelto y miscible, se calientan hasta eliminar el solvente, pero este se recolecta en otro recipiente mientras el sólido o el aceite permanecen en el recipiente inicial.
Destilación del aire
El aire condensado se somete a destilación fraccionada criogénica para separar el oxígeno, nitrógeno, argón, neón, etc. El aire, una mezcla gaseosa homogénea, se transforma en un líquido donde el nitrógeno, por ser el componente mayoritario, actúa en teoría como solvente; y los otros gases, condensados también, como solutos líquidos.
La cromatografía, a diferencia de las otras técnicas, no puede brindar rendimientos ni remotamente parecidos; es decir, no es útil para procesar toda una mezcla, sino una fracción insignificante de la misma. Sin embargo, la información que provee es analíticamente valiosísima, pues identifica y clasifica las mezclas con base a su composición.
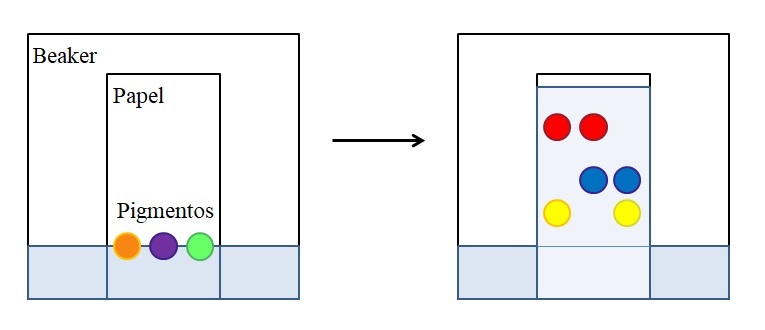
Existen diferentes tipos de cromatografías, pero la más simple, la que se explica en los colegios o cursos preuniversitarios, es la del papel, cuyo principio es el mismo que el desarrollado sobre una capa fina de un material absorbente (comúnmente sílica gel).
En la imagen superior se muestra que en un beaker, lleno de agua o un solvente determinado, se coloca un papel al que se le ha marcado una línea de referencia con gotas o puntos de tres pigmentos seleccionados (anaranjado, morado y verde). El beaker se mantiene cerrado para que la presión sea constante y se sature de los vapores del solvente.
Entonces, el líquido comienza a ascender por el papel y arrastra los pigmentos. Las interacciones pigmento-papel no son todas iguales: algunas son más fuertes, y otras más débiles. Mientras más afinidad sienta el pigmento por el papel, menos ascenderá a través del papel respecto a la línea que se marcó inicialmente.
Por ejemplo: el pigmento rojo es el que siente menos afinidad por el solvente, mientras que el amarillo apenas ascendió debido a que el papel lo retiene más. Se dice entonces que el solvente es la fase móvil, y el papel la fase estacionaria.
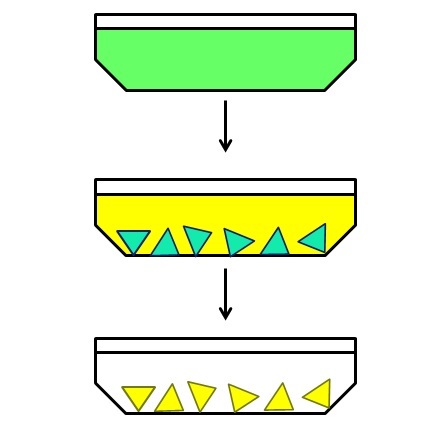
Y para finalizar se tiene la cristalización fraccionada. Esté método podría quizás catalogarse como un híbrido, pues se parte de una mezcla homogénea para terminar con una heterogénea. Por ejemplo, supóngase que se tiene una disolución en la cual se ha disuelto un sólido de color verde (imagen superior).
Las partículas verdes son demasiado pequeñas para separarse manual o mecánicamente. Se halla además que el sólido verde es una mezcla de dos componentes y no un único compuesto de este color.
Entonces, se calienta una disolución del mismo y se le deja en reposo mientras va enfriándose. Resulta que los dos componentes, aunque muy afines entre sí, sus solubilidades en determinado solvente son ligeramente diferentes; por lo tanto, uno de los dos comenzará a cristalizar primero y después el otro.
El componente verde-azulado (en el medio de la imagen) es el primero en cristalizar, mientras el componente amarillo sigue disuelto. Al haber cristales verdes-azulados, estos se filtran en caliente antes de que aparezcan los cristales amarillos. Luego, a medida que el solvente se enfría un poco más, el componente amarillo cristaliza y se hace otra filtración.
Métodos de separación de mezclas.
Métodos de separación de mezclas heterogéneas.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Chelsea Schuyler. (2019). Chromatography, Distillation and Filtration: Methods of Separating Mixtures. Study. Recuperado de: study.com
- CK-12 Foundation. (16 de octubre de 2019). Methods for Separating Mixtures. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Good Science. (2019). Separation of Mixtures. Recuperado de: goodscience.com.au
- Clark Jim. (2007). Thin layer chromatography. Recuperado de: chemguide.co.uk
