Tinción de esporas: fundamento, técnicas y usos
La tinción de esporas es la metodología usada para colorear las estructuras de resistencia que forman algunos géneros bacterianos cuando se encuentran en condiciones desfavorables; estas estructuras corresponden a una forma de supervivencia.
Existen muchos géneros que forman esporas; sin embargo, los principales son Bacillus y Clostridium. Estos géneros se consideran más relevantes debido a que poseen especies patógenas para el ser humano.

Cada bacilo puede dar origen a una espora. Al momento de teñir la preparación, la espora se puede encontrar dentro del bacilo (endospora) o fuera de este (exospora). Con las técnicas de coloración convencionales para bacterias —como la tinción de Gram— las esporas quedan incoloras.
En la actualidad se cuentan con varias metodologías de coloración que son capaces de atravesar la gruesa estructura de la espora para teñirla. Estas metodologías son muy variadas; entre estas se pueden mencionar la técnica de Dorner, la tinción de Möeller y la metodología de Shaeffer–Fulton, también conocida como Wirtz-Conklin.
De todas las técnicas mencionadas, la metodología de Shaeffer-Fulton es la más utilizada en los laboratorios de rutina. Debe su nombre a dos microbiólogos que crearon la coloración en 1930: Alicia Shaeffer y MacDonald Fulton. Sin embargo, en ocasiones la técnica es denominada Wirtz-Conklin en honor a dos bacteriólogos de los años 1900.
Índice del artículo
Las esporas no se tiñen con las coloraciones convencionales debido a que poseen una pared muy gruesa. La compleja composición de las esporas impide la entrada de la mayoría de los colorantes.
Si se estudia la espora de afuera hacia dentro se observan las siguientes capas: en primer lugar está el exosporium, que es la capa más fina y externa formada por glicoproteínas.
Luego viene la cutícula, que brinda resistencia a las altas temperaturas, seguida de la corteza compuesta por peptidoglicano. Posteriormente está la pared de la base que protege al protoplasto.
La espora es una estructura deshidratada que contiene un 15 % de calcio y ácido dipicolínico. Por ello, la mayoría de las técnicas de coloración de esporas se basan en la aplicación de calor para que el colorante pueda penetrar la gruesa estructura.
Una vez que la espora se tiñe, esta no puede eliminar al colorante. En la técnica de Shaeffer–Fulton el verde de malaquita entra a las células vegetativas y, al aplicar el calor, penetra en la endospora y también en las exosporas.
Al lavar con agua, el colorante se elimina de la célula vegetativa. Esto ocurre porque el tinte verde de malaquita es ligeramente básico, por lo que se une débilmente a la célula vegetativa.
En cambio, no puede salirse de la espora y finalmente se contratiñe el bacilo con safranina. Este fundamento es válido para el resto de las técnicas, en las que ocurre algo similar.
Para realizar la tinción de esporas se debe tener un cultivo puro de la cepa sospechosa que se quiere estudiar.
El cultivo se somete a temperaturas extremas durante 24 horas para estimular al microorganismo a esporular. Para ello se puede colocar el cultivo en una estufa a 44 °C o en nevera (8 °C) durante 24 o 48 horas.
Si se deja demasiado tiempo a las temperaturas mencionadas, solo se observarán exosporas, pues ya todas las endosporas habrán salido del bacilo.
Culminado el tiempo se deben colocar unas gotas de solución fisiológica estéril sobre un portaobjeto limpio. Luego se toma una pequeña porción del cultivo y se realiza un extendido fino.
Posteriormente se deja secar, se fija al calor y se tiñe con alguna de las técnicas que se explican a continuación:
1- Preparar en un tubo de ensayo una suspensión concentrada del microorganismo esporulado en agua destilada y agregar un volumen igual de fucsina fenicada de Kinyoun filtrada.
2- Colocar el tubo en un baño con agua en ebullición durante entre 5 y 10 minutos.
3- Sobre un portaobjetos limpio mezclar una gota de la suspensión anterior con una gota de solución acuosa de nigrosina al 10 %, hervida y filtrada.
4- Extender y secar rápidamente con calor suave.
5- Examinar con objetivo de 100X (inmersión).
Las esporas se tiñen de color rojo y las células bacterianas aparecen casi incoloras contra un fondo gris oscuro.
1- Se hace un extendido de una suspensión del microorganismo esporulado en un portaobjeto y se fija al calor.
2- La muestra se cubre con una tira de papel de filtro a la que se le agrega fucsina fenicada. El colorante se calienta de 5 a 7 minutos con la llama del mechero de Bunsen hasta que se genere el desprendimiento de vapores. Luego se retira el papel.
3- Se lava la preparación con agua y luego se seca con papel absorbente.
4- Se cubre el frotis con una película delgada de nigrosina al 10 %, usando un segundo portaobjeto para extender la nigrosina o una aguja.
La coloración que toman las esporas y las bacterias es igual a la descrita en la técnica anterior.
1- Hacer un extendido fino con una suspensión del microorganismo esporulado en un portaobjeto y fijar al calor.
2- Cubrir el portaobjetos con solución acuosa de verde de malaquita al 5 % (se puede colocar un papel de filtro sobre la lámina).
3- Calentar sobre la llama del mechero de Bunsen hasta causar desprendimiento de vapores y retirar la llama. Repetir la operación durante de 6 a 10 minutos. Si durante el procedimiento se evapora demasiado la solución de verde de malaquita, se puede agregar más.
4- Retirar el papel de filtro (si fue colocado) y lavar con agua.
5- Cubrir el portaobjetos con safranina acuosa al 0,5 % durante 30 segundos (algunas variantes de la técnica usan safranina acuosa al 0,1 % y la dejan por 3 minutos).
Con esta técnica las esporas se presentan de color verde y los bacilos de color rojo.
Tiene el inconveniente de que las endosporas de cultivos jóvenes no se tiñen bien, dado que se ven extremadamente claras o incoloras. Para evitar esto se recomienda usar cultivos de 48 horas de incubación.
1- Cubrir el frotis con cloroformo por 2 minutos.
2- Descartar el cloroformo.
3- Cubrir con ácido crómico al 5 % durante 5 minutos.
4- Lavar con agua destilada
5- Se cubre la lámina con carbol fucsina-fenicada y se expone a la llama del mechero de Bunsen hasta la emisión de vapores; luego se retira de la llama unos instantes. Se repite la operación hasta cumplir 10 minutos.
6- Lavar con agua.
7- Usar etanol acidificado (alcohol clorhídrico) para decolorar. Se deja durante 20 o 30 segundos.
8- Lavar con agua destilada.
9- Contrateñir cubriendo la lámina con azul de metileno por 5 minutos.
10- Lavar con agua destilada.
11- Se deja secar y se lleva la muestra al microscopio.
Las esporas se ven de color rojo y los bacilos azules. Es importante no aspirar los vapores, pues son tóxicos y a largo plazo pueden ser cancerígenos.
En el año 2007 Hayama y sus colaboradores crearon una modificación de la técnica de Möeller. Eliminaron el paso del calentamiento del colorante y lo sustituyeron por la adición de 2 gotas del surfactante Tergitol 7 por cada 10 ml de solución de carbol fucsina-fenicada. Se obtuvieron los mismos resultados.
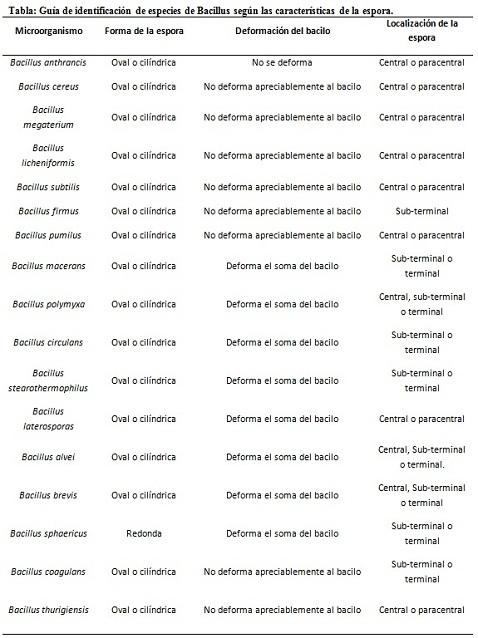
La coloración de esporas brinda una información muy valiosa y útil para la identificación del patógeno, pues la presencia de la misma, su forma, ubicación dentro del bacilo y la capacidad de deformar la célula vegetativa o no, son datos que pueden orientar sobre la especie involucrada dentro de un determinado género.
En este contexto, vale decir que las esporas pueden ser redondas u ovaladas, pueden estar ubicadas en el centro o también en posición paracentral, subterminal o terminal.
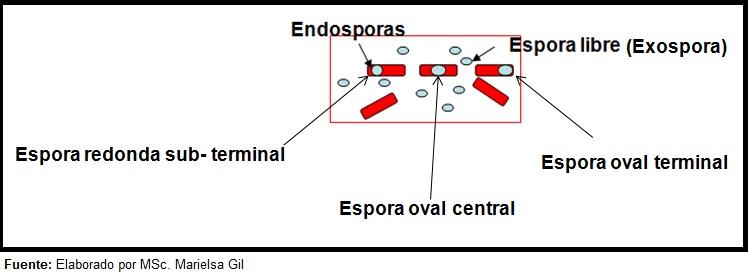
– Clostridium difficile forma una espora oval en posición terminal que deforma el bacilo.
– La espora de Clostridiumtertium es oval, no deforma al bacilo y se ubica a nivel terminal.
– La endospora de Clostridium tetani es terminal y deforma al bacilo, dando el aspecto de un palillo de tambor.
– Las esporas de Clostridium botulinum, C. histolyticum, C. novy y C. septicum son redondas u ovales subterminales y deforman al bacilo.
– La endospora de Clostridium sordelli se ubica en la posición central, con una leve deformación.
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Proposal of a simplified technique for staining bacterial spores without applying heat–successful modification of Moeller’s method. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Wikipedia contributors. Moeller stain. Wikipedia, The Free Encyclopedia. November 3, 2018, 03:28 UTC. Available en: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Manual de Laboratorio de Técnicas Microbiológicas. Departamento de Ciencias Básicas Academia de Microbiología. Instituto Politécnico Nacional.
- “Endospora.” Wikipedia, La enciclopedia libre. 25 feb 2018, 10:20 UTC. 10 ene 2019, 02:42: es.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J y colaboradores. (2006). Personal Laboral de la comunidad autónoma de Extremadura. Temario específico Volumen IV. Editorial MAD. Sevilla-España, pp 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006).Técnico especialista en laboratorio, del Servicio Gallego de Salud (SERGAS). Temario materia específicas volumen 2. Editorial MAD. Sevilla-España, pp 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. (5ta ed.). Argentina, Editorial Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Argentina. Editorial Panamericana S.A
