Tinción de Gram: qué es, fundamento, materiales, técnica, usos
¿Qué es la tinción de Gram?
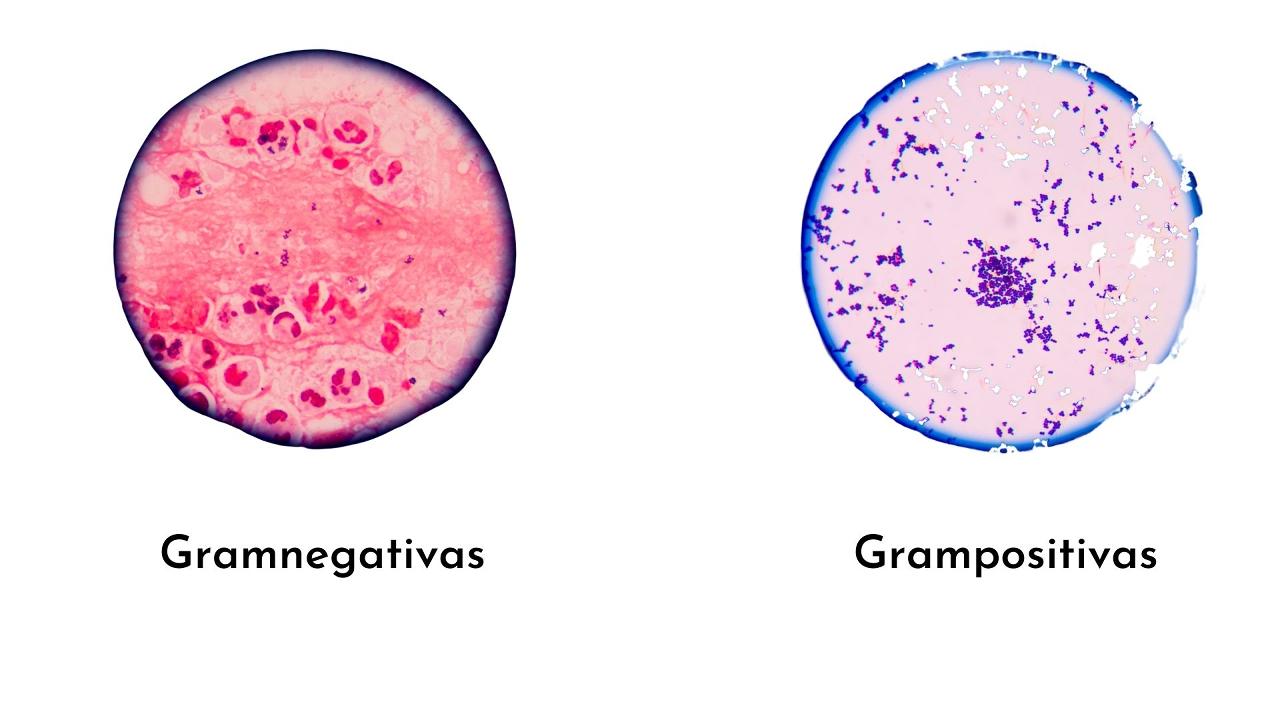
La tinción de Gram es la técnica de coloración más sencilla y más útil en microbiología diagnóstica para identificar bacterias. Esta técnica fue creada por el médico danés Christian Gram en 1884, quien clasificó las bacterias en grampositivas (color morado) y gramnegativas (color rosado), de acuerdo a la composición de la pared celular.
La técnica sufrió ciertas modificaciones por Hucker en 1921 para estabilizar los reactivos y mejorar la calidad de la tinción, por lo que la tinción de Gram también se conoce como Gram-Hucker.
Con esta técnica también es posible observar la forma que tienen los microorganismos, es decir, si son cocos, bacilos, cocobacilos, pleomórficos, filamentosos, entre otros. Así como también su distribución en el espacio: en racimo, en cadena, aislados, en pares, en tétradas, etc.
Fundamento
Es una técnica que presenta 4 pasos fundamentales: tinción, fijación con el mordiente, decoloración y contratinción. Por tanto, además de colorear las bacterias, también permite diferenciarlas.
El cristal violeta es el primer colorante utilizado. El mismo tiene afinidad por el peptidoglicano y teñirá de morado a todas las bacterias presentes, posteriormente se coloca el lugol, que actúa como mordiente, es decir, inducirá a la formación de complejos insolubles de cristal violeta/yodo/proteínas ribonucleares dentro de la célula.
Las bacterias grampositivas, al tener una pared gruesa de peptidoglicano, forman más complejos (cristal violeta/yodo), por tanto, se teñirán de morado.
También influye que la pared de las bacterias grampositivas contienen mayor cantidad de ácidos no saturados, los cuales muestran gran afinidad por los agentes oxidantes (lugol).
Las bacterias gramnegativas poseen una capa delgada de peptidoglicano, lo que hace que las bacterias formen menos complejos que las grampositivas.
Posteriormente viene el paso de la decoloración, donde las bacterias grampositivas y gramnegativas se comportan de manera diferente.
Las bacterias gramnegativas contienen una membrana externa rica en lipopolisacáridos que forma parte de su pared celular. Las grasas son destruidas por el contacto con el alcohol acetona, por lo que la membrana externa se desestabiliza, siendo liberado el cristal violeta.
Es así como luego es contrateñida con la safranina o fucsina básica, tomando el color rojo.
En el caso de las bacterias grampositivas, resisten la decoloración porque el decolorante actúa cerrando los poros, lo que impide que el complejo cristal violeta/yodo pueda salirse.
Por tanto, se mantiene estable la coloración con el cristal violeta, y no hay cabida para la safranina o la fucsina. Por esto, estas bacterias se tiñen de azul intenso o morado.
Materiales
El set de coloración de Gram está compuesto por:
– Cristal violeta.
– Lugol.
– Alcohol acetona.
– Safranina o fucsina básica.
Preparación de los colorantes y reactivos
Solución cristal violeta
Solución A:
Cristal violeta ————————————- 2 gr
Alcohol etílico 95% ——————————— 20 cc
Solución B:
Oxalato de amonio ——————————— 0.8 gr
Agua destilada————————————– 80 cc
Para la preparación final del cristal violeta se debe diluir la solución A 1:10 con agua destilada y mezclar con 4 partes de la solución B. Se almacena la mezcla durante 24 horas antes de usarla. Se filtra en un frasco para tinción color ámbar usando un filtro de papel.
La cantidad que se usa diariamente se traslada a un frasco ámbar con gotero.
Iodo-Lugol
Pesar y medir la cantidad indicada de cada compuesto, tal como sigue:
Cristales de Iodo ————————————- 1 gr
Ioduro de potasio ———————————— 2 gr
Agua destilada ————————————— 300 cc
Se disuelve el ioduro de potasio poco a poco en el agua y posteriormente se agreda el iodo. Se traslada la solución a un frasco color ámbar.
La cantidad que se usa diariamente se traslada a un frasco ámbar más pequeño con gotero.
Decolorante
Alcohol etílico al 95% ———————————– 50 ml
Acetona ————————————————– 50 ml
Se prepara a partes iguales. Tapar bien, pues tiende a evaporarse.
Colocar en frasco con gotero.
Esta preparación proporciona una decoloración en tiempo moderado 5-10 seg., y es la más recomendada.
Los principiantes prefieren usar solo alcohol etílico al 95%, donde la decoloración es más lenta, de 10 a 30 seg.
Mientras que los más experimentados pueden usar acetona pura, donde la decoloración ocurre muy rápidamente de 1 a 5 seg.
Contraste
Solución madre de safranina
Safranina ————————————– 2.5 gr
Alcohol etílico 95% ————————– 100 cc
Después de pesar la cantidad indicada de safranina, se disuelve en 100 cc de alcohol etílico a 95%.
A partir de la solución madre se prepara la solución de safranina de trabajo.
Para ello, medir 10 cc de la solución madre, agregar 90 cc de agua destilada para completar 100 ml.
Se recomienda traspasar la cantidad que se use diariamente a un frasco ámbar con gotero.
Los microorganismos que se tiñen débilmente de gramnegativos con la tinción de Gram-Hucker, como ciertos anaerobios, Legionella sp, Campylobacter sp y Brucella sp, pueden teñirse mucho mejor si se usa la modificación que realizó Kopeloff a la tinción de Gram-Hucker, denominada tinción de Gram-Kopeloff.
Esta técnica cambia el colorante de safranina por fucsina básica. Con esta modificación, es posible colorear eficazmente los microorganismos antes mencionados.
Almacenamiento de los reactivos
Los colorantes preparados se deben guardar a temperatura ambiente.
Preparación del extendido de la muestra a colorear
Una muestra debe contener por lo menos 105 microorganismos antes de que sea probable su observación en un frotis. Los extendidos pueden realizarse de la muestra directa o de cultivos en medios sólidos o líquidos.
Los extendidos deben ser uniformes, bien distribuidos y no muy gruesos, para una mejor visualización de las estructuras presentes.
Gram de muestras directas
Gram de orina sin centrifugar
Se mezcla la orina y se colocan 10 µl en un portaobjetos. La observación de al menos una bacteria/Campo de inmersión indica que existe infección.
Esto quiere decir que el cultivo tendrá aproximadamente más de 100.000 UFC/ml (105 UFC/mL) de orina en el 85% de los casos.
Este método no es útil para recuentos de colonias por debajo de 100.000 UFC.
Gram de LCR
Se debe centrifugar el LCR, se retira el sobrenadante y se extiende el sedimento en una lámina portaobjetos. Este líquido es estéril en condiciones normales. La observación de bacterias indica infección.
Gram de muestras respiratorias
El Gram de esputo, lavado bronquial o broncoalveolar, si bien puede haber variedad de microorganismos, siempre orientará en el diagnóstico, además de ser útil el tipo de células observadas.
En el caso de esputos, se debe preparar el extendido con las porciones más purulentas de la muestra.
Gram de heces
No es recomendable realizar Gram a este tipo de muestras, ya que no tiene valor diagnóstico.
Gram de cultivos
Pueden realizarse de dos maneras, una a partir de cultivos líquidos y otra a partir de cultivos sólidos.
Cultivos líquidos
A partir de cultivos líquidos es sumamente sencillo: bajo el mechero se toman varias asadas del caldo turbio y se colocan sobre un portaobjetos limpio y seco, dando movimientos circulares desde el centro hacia la periferia, para distribuir el material uniformemente.
Se deja secar espontáneamente al aire. Una vez seco, se fija el material a la lámina con calor. Para ello, con ayuda de una pinza se pasa la lámina 3 a 4 veces por la llama del mechero de Bunsen, con cuidado de no quemar el material.
La lámina se deja enfriar y se coloca sobre el puente de coloración.
Cultivos sólidos
Para realizar un extendido para tinción de Gram a partir de un cultivo sólido se procede de la siguiente manera:
Antes de elegir las colonias a tomar, se debe preparar la lámina portaobjetos, colocando dos gotas aproximadamente de solución salina fisiológica estéril.
Si la placa original de cultivo contiene varios tipos de colonias diferentes, se elegirá una colonia aislada de cada una para realizar el Gram. Cada colonia se tomará con el asa de platino para disolverla en la solución salina colocada previamente en el portaobjetos.
Se dan movimientos circulares desde el centro hacia la periferia, para distribuir homogéneamente la colonia en la lámina portaobjetos.
Se deja secar espontáneamente al aire. Una vez seco, se fija la lámina con calor, como se explicó anteriormente (flameando la lámina portaobjetos con el mechero), cuidando no quemar el material.
Este procedimiento se debe realizar con cada tipo de colonia diferente. En un papel se debe anotar el orden de lo observado, por ejemplo:
Colonia 1: Colonia amarilla betahemolítica: se observaron cocos grampositivos en racimos.
Colonia 2: Colonia color crema, sin hemólisis: se observaron cocobacilos gramnegativos.
Se debe rotular cada lámina para saber qué estamos observando.
Técnica
La técnica de coloración de Gram es extremadamente sencilla de realizar y relativamente económica, y no puede faltar en un laboratorio de microbiología.
La misma se realiza de la siguiente manera:
- Fijar el frotis con calor y colocar sobre el puente de coloración.
- Se cubre la lámina completamente con cristal violeta por 1 minuto.
- Lavar con agua. No secar.
- Cubrir la lámina con solución de lugol, dejar actuar durante 1 minuto. Lavar con agua. No secar.
- Decolorar por 5-10 segundos con agitación suave en alcohol acetona. O colocar la lámina en posición vertical y dejar caer gotas del decolorante sobre la superficie hasta que arrastre el sobrante de cristal violeta no retenido. No exceder.
- Lavar con agua. No secar.
- Volver a colocar la lámina sobre el puente de coloración y cubrir por 30 seg con safranina (Gram-Hucker) o 1 min con fucsina básica (Gram-Kopeloff).
- Lavar con agua.
- Dejar secar espontáneamente al aire en posición vertical.
Una vez seco, colocar 1 gota de aceite de inmersión para observarlo bajo el objetivo de 100X en el microscopio óptico.
Usos/aplicaciones de la tinción de Gram
– Esta técnica permite distinguir las diferencias morfotintoriales de la mayoría de las bacterias.
– Las levaduras también se distinguen con esta coloración. Ellas toman el cristal violeta, es decir, se tiñen de grampositivo.
– Se pueden distinguir bacilos grampositivos formadores de esporas, donde se observa un espacio claro dentro del bacilo donde se formó la endospora, aunque las esporas no se tiñen bien. Para teñir esporas se usan otras técnicas, como Shaeffer-Fulton.
– Ayuda a determinar el tipo de antibiótico que debe prepararse.
Cabe destacar que esta tinción no sirve para colorear todo tipo de bacterias, es decir, existen casos en los que la tinción no funciona.
En estos casos, se pueden mencionar las bacterias que carecen de pared celular. Por ejemplo: género Mycoplasma, esferoplastos, Ureaplasma, formas L y protoplastos.
Además tiñe muy mal las bacterias con paredes ricas en ácidos micólicos, como las Mycobacterias, y las bacterias intracelulares, como Chlamydias y Rickettsias.
Igualmente es ineficaz para teñir la mayoría de las bacterias espiroquetales.
Hay bacterias de un mismo género que pueden observarse en la misma muestra como grampositivas y como gramnegativas. Cuando esto sucede se le llama tinción de Gram variable, lo que puede deberse a alteración en nutrientes, temperatura, pH o concentración de electrolitos.
Errores comunes
Decolorar exageradamente
Exagerar en el paso de decoloración puede ocasionar la observación de falsos microorganismos gramnegativos.
No esperar el tiempo suficiente de secado para agregar el aceite de inmersión
Este error ocasiona que se formen micelas de grasa que dificultan la observación de las estructuras presentes. Esto ocurre cuando el aceite se une a las moléculas de agua presentes en el frotis.
Invertir el orden de los reactivos
Un error como este generará que las bacterias gramnegativas se visualicen moradas, es decir, falsos grampositivos.
Utilizar cultivos viejos (sólidos o líquidos)
Puede ocasionar que las bacterias grampositivas se tiñan de gramnegativo (falso gramnegativo). Esto pasa porque en los cultivos viejos es probable que haya bacterias muertas o deterioradas, y bajo estas condiciones las bacterias no retienen el cristal violeta.
Utilizar solución de lugol muy vieja
Con el tiempo, el lugol va perdiendo sus propiedades y su color se va desvaneciendo. Si se utiliza el reactivo ya degenerado, este no fijará bien el cristal violeta, por tanto hay posibilidad de obtener una visualización de microorganismos falsamente gramnegativos.
Fondo azuloso
Un fondo adecuadamente decolorado será rojo. Un fondo azul indica que la decoloración fue insuficiente.
Referencias
- Casas-Rincón, G. (1994). Micología General. Universidad Central de Venezuela.
- Tinción de Gram. Tomado de es.wikipedia.org.
- González, M., González, N. (2011). Manual de Microbiología Médica. Dirección de medios y publicaciones de la Universidad de Carabobo.
