Ácido bórico: estructura química, propiedades, preparación, usos
El ácido bórico es un compuesto inorgánico cuya fórmula química es H3BO3. Consiste de un sólido blanco o incoloro. Es un ácido débil que en solución acuosa produce, dependiendo de su concentración, un pH comprendido entre 3,8 y 4,8. Es poco soluble en agua fría y moderadamente soluble en agua caliente.
El ácido bórico fue descubierto en 1702 por Wilhelm Homberg (1652-1713), quien trató el bórax con ácido sulfúrico, obteniendo una solución con acción medicinal que recibió el nombre de agua sedativa de Homberg.

Sin embargo, también se señala que Homberg preparó el ácido bórico agregando agua al bórax y calentando la solución hasta evaporarla, quedando así en el sedimento los cristales de ácido bórico.
Este ácido es un compuesto de gran utilidad que tiene numerosas aplicaciones en la industria y en la medicina, usándose también como insecticida, preservación de la madera, retardante del fuego y es un constituyente de una solución amortiguadora del pH.
Índice del artículo
- 1 Estructura química
- 2 Propiedades
- 2.1 Nombres
- 2.2 Masa molar
- 2.3 Apariencia física
- 2.4 Olor
- 2.5 Sabor
- 2.6 Punto de fusión
- 2.7 Punto de ebullición
- 2.8 Solubilidad en agua
- 2.9 Solubilidad en otros solventes
- 2.10 Coeficiente de partición octanol/agua
- 2.11 Acidez (pKa)
- 2.12 pH
- 2.13 Presión de vapor
- 2.14 Estabilidad
- 2.15 Descomposición
- 2.16 Reactividad
- 3 Preparación
- 4 Usos
- 5 Contraindicaciones
- 6 Referencias
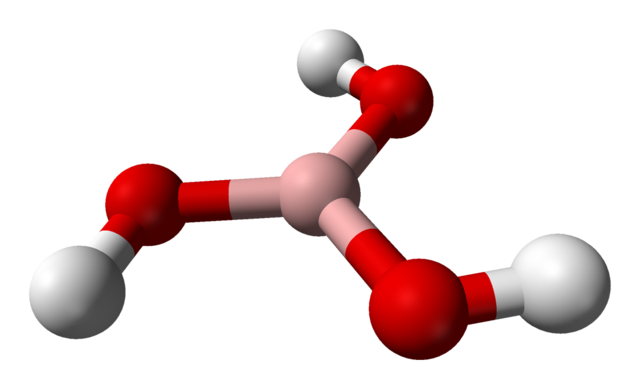
En la imagen superior tenemos la molécula propiamente dicha del H3BO3. Nótese que los átomos de hidrógeno, representado por esferas blancas, no se encuentran enlazados al átomo central de boro, como pudiera sugerir la fórmula química; sino más bien, a los átomos de oxígeno, representados por esferas rojas.
Es así que una fórmula más conveniente, aunque menos utilizada, para el ácido bórico es B(OH)3, indicando que su acidez se debe a los iones H+ liberados de sus grupos OH. La molécula B(OH)3 posee una geometría plano trigonal, con su átomo de boro teniendo una hibridación química sp2.
El B(OH)3 es una molécula de alto carácter covalente, pues la diferencia de electronegatividad entre el átomo de boro y el oxígeno no es muy grande; por lo que los enlaces B-O son en esencia covalentes. Nótese además que la estructura de esta molécula se asemeja a la de un spinner. ¿Podrá girar sobre su propio eje del mismo modo?
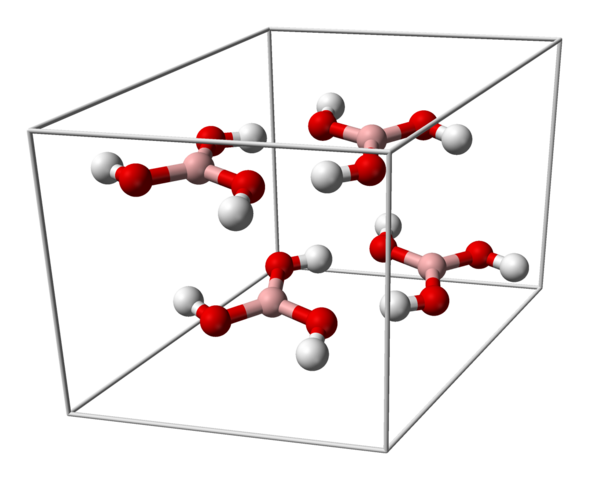
En la imagen superior se muestra la celda unitaria correspondiente a la estructura cristalina triclínica para el ácido bórico la cual, bajo ciertas condiciones de síntesis, puede adoptar la estructura hexagonal compacta. Nótese que hay cuatro moléculas por celda unitaria, y que se ordenan en dos capas, A y B, alternadas (no están superpuestas una encima de la otra).
Debido a la simetría y orientación de los enlaces B-OH, puede suponerse que el B(OH)3 es apolar; sin embargo, la existencia de los puentes de hidrógeno intermoleculares cambia la historia. Cada molécula de B(OH)3 de dar o recibir tres de dichos puentes, con un total de seis interacciones dipolo-dipolo, como las observadas en la imagen de abajo:
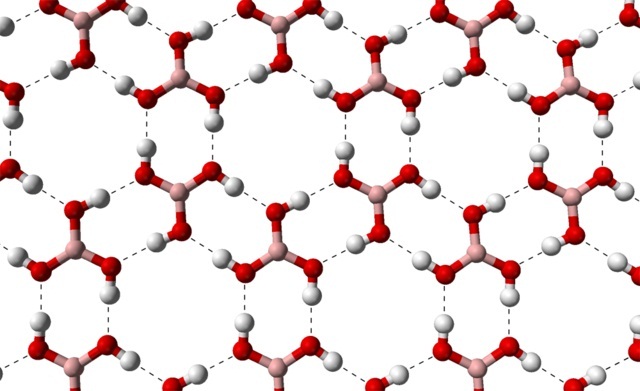
Nótese que estos puentes de hidrógeno son las interacciones direccionales que rigen los cristales de ácido bórico, y establecen patrones de aspectos ornamentales; anillos internos quizás con el espacio suficiente para ocluir algunas impurezas que no estén en los defectos cristalinos.
Estos puentes de hidrógeno, pese a la baja masa molecular del B(OH)3, mantienen lo suficientemente cohesionado su cristal que necesita de una temperatura de 171 ºC para fundirse. Se desconoce qué efectos tendría altas presiones (en el orden de los GPa) sobre las capas moleculares de B(OH)3.
IUPAC: ácido bórico y trihidrooxidoboro. Otros nombres: ácido ortobórico, ácido borácico, sassolite, borofax y trihidroxiborano.
61,83 g/mol
Sólido blanco cristalino, incoloro y transparente. También se consigue como gránulos o en forma de polvo blanco. Ligeramente untuoso al tacto.
Inodoro
Ligeramente amargo
170,9 ºC
300 ºC
Moderadamente soluble en agua fría y soluble en agua caliente:
2,52 g/100 mL (0 ºC)
27,50 g/100 mL (100 ºC)
El ácido bórico es parcialmente soluble en agua y tiende a hundirse en ella. Dicha solubilidad tiende a aumentar en presencia de ácidos, tales como el clorhídrico, cítrico y tartárico.
-Glicerol: 17,5 % a 25 ºC
-Etilenglicol: 18,5 % a 25 ºC
-Acetona: 0,6 % a 25 ºC
-Acetato de etilo: 1,5 % a 25 ºC
-Metanol: 172 g/L a 25 ºC
-Etanol: 94,4 g/L a 25 ºC
Log P = -0,29
9,24. 12,4. 13,3. Estas son las tres constantes de sus respectivas disociaciones para liberar H+ en agua.
3,8 – 4,8 (3,3 % en solución acuosa)
5,1 (0,1 molar)
1,6·10-6 mmHg
Estable en el agua
Se descompone cuando se calienta por encima de 100 ºC, formando anhídrido bórico y agua.
El ácido bórico forma sales solubles con cationes monovalentes, por ejemplo: Na2B4O7.10H2O, y sales insolubles con cationes divalentes, CaB4O7.6H2O.
En solución acuosa produce una solución ácida, pensándose que esta propiedad se debía a la sustracción de grupos OH– del agua. El ácido bórico es calificado como un ácido débil del tipo Lewis.
El ácido bórico reacciona con el glicerol y el manitol, incrementando la acidez del medio acuoso. El pKa se modifica de 9,2 a 5, debiéndose a la formación del quelato boro-manitol [BC6H8O2(OH)2]–, el cual libera H+.
El ácido bórico se encuentra en estado libre en las emanaciones volcánicas en regiones como la Toscana de Italia, Islas Lipari y en el estado de Nevada, USA. También se encuentra en minerales como el bórax, la boracita, ulexita y la colemanita.
El ácido bórico se prepara principalmente por la reacción del mineral bórax (tetraborato sódico decahidrato) con ácidos minerales, tales como el ácido clorhídrico, el ácido sulfúrico, etc.
Na2B4O9·10H2O + HCl => 4 H3BO3 + 2 NaCl + 5 H2O
También se prepara mediante la hidrólisis del trihaluro de boro y diborano.
El ácido bórico es preparado a partir de la colemanita (Ca2B6O11·6 H2O). El procedimiento consiste en el tratamiento del mineral con ácido sulfúrico para disolver los compuestos de boro.
Luego, se separa la solución donde está presente el ácido bórico de los fragmentos no disueltos. Se trata la solución con sulfuro de hidrógeno para precipitar las impurezas de arsénico y hierro. El sobrenadante es enfriado para producir un precipitado de ácido bórico y separarlo de la suspensión.
El ácido bórico se utiliza en la elaboración de la fibra de vidrio. Al contribuir a reducir el punto de fusión, incrementa la fortaleza y la eficiencia de la fibra de vidrio textil: material utilizado para reforzar el plástico usado en las embarcaciones, tuberías industriales y placas de circuitos de computación.
El ácido bórico participa en la fabricación del vidrio borosilicado, el cual permite la obtención de un vidrio resistente a los cambios de temperatura, utilizable en la cocina de los hogares, en el material de vidrio de los laboratorios, los tubos fluorescentes, la fibra óptica, las pantallas LCD, etc.
Se usa en la industria metalúrgica para endurecer y tratar aleaciones de acero, así como favorecer el revestimiento metálico de los materiales.
Se usa como componente químico en la fracturación hidráulica (fracking): método utilizado en la extracción petrolera y gasífera. El ácido bórico actúa como retardante del fuego en materiales de celulosa, plásticos y textiles que son impregnados con ácido bórico para aumentar su resistencia al fuego.
El ácido bórico se usa diluido en el lavado de los ojos. Se usan cápsulas de gelatina de ácido bórico para el tratamiento de las infecciones fúngicas, especialmente de Candida albicans. También se ha utilizado en el tratamiento del acné.
El ácido bórico se espolvorea en los calcetines para prevenir infecciones de los pies, tal como el pie de atleta. Asimismo, se usan soluciones que contienen ácido bórico en el tratamiento de la otitis externa en humanos, así como en animales.
El ácido bórico es agregado en las botellas usadas para la recolección de la orina, lo que evita su contaminación bacteriana antes de ser examinadas en los laboratorios diagnósticos.
El ácido bórico es utilizado en el control de la proliferación de insectos, como cucarachas, termitas, hormigas, etc. No mata al instante las cucarachas, pues afecta primero sus sistemas digestivo y nervioso, además de destruir su exoesqueleto.
El ácido bórico ejerce su acción lentamente, permitiendo que los insectos que lo han ingerido entren en contacto con otros insectos, propagando así el envenenamiento.
El ácido bórico se usa para prevenir el ataque de la madera por hongos e insectos, usándose para este fin en conjunción con el etilenglicol. Este tratamiento también es efectivo en el control del limo y de las algas.
El ácido bórico y su base conjugada forman un sistema amortiguador de pKa = 9,24, lo que señala que este amortiguador tiene su mayor eficacia a pH alcalinos, los cuales no son usuales en los seres vivos. Sin embargo, el amortiguador borato se usa en la regulación del pH en las piscinas.
El ácido bórico tiene la capacidad de captar neutrones térmicos, lo cual reduce la posibilidad de fisión nuclear no controlada que pueda producir accidentes nucleares.
El boro es un elemento esencial para el crecimiento de las plantas, lo que indujo al uso del ácido bórico para el aporte del elemento. Sin embargo, en exceso el ácido bórico puede dañar las plantas, especialmente los cítricos.
Debe evitarse el uso del ácido bórico sobre la piel denudada, producto de herida o quemadura que permita la absorción del mismo. Este es un compuesto tóxico en el interior corporal y en algunos casos, puede producir desmayos, convulsiones, espasmos, tics faciales e hipotensión arterial.
Debe consultarse al médico para el uso de cápsulas vaginales de ácido bórico en mujeres embarazadas, ya que se ha señalado que podría producir deformaciones fetales y una disminución del peso corporal del niño al nacer.
Debe asimismo evitarse la colocación del ácido bórico, usado como insecticida, en lugares que estén al alcance de los niños, ya que los niños tienen una mayor susceptibilidad a la acción tóxica del ácido bórico, estableciéndose en ellos la dosis fatal en 2.000 a 3.000 mg.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Boric acid. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Boric acid. PubChem Database. CID=7628. Recuperado de: pubchem.ncbi.nlm.nih.gov
- The Editors of Encyclopaedia Britannica. (28 de marzo de 2019). Boric acid. Encyclopædia Britannica. Recuperado de: britannica.com
- Carrier Vibrating. (09 de noviembre de 2018). The Hidden Uses of Boric Acid In Your Daily Life. Recuperado de: carriervibrating.com
- National Pesticide Information Center. (s.f.). Boric acid. Recuperado de: npic.orst.edu
- Redacción. (30 de noviembre de 2017). Ácido bórico: propiedades y usos de este compuesto químico. Recuperado de: acidos.info
- Clorurosodio. (2019). Ácido Bórico. Recuperado de: clorurosodio.com
- Sociedad Española de Farmacia Hospitalaria. (s.f.). Ácido bórico. [PDF]. Recuperado de: gruposdetrabajo.sefh.es
