Sublimación: concepto, proceso y ejemplos
La sublimación es un proceso termodinámico en el que ocurre un cambio de estado endotérmico directamente de un sólido a un gas, sin la formación previa del líquido. Un ejemplo destacado de este proceso es el del hielo seco; al ser expuesto al sol o sumergido en un líquido pasa directamente del estado sólido a gaseoso.
El comportamiento del sólido en condiciones normales es el de calentarse y originar una primera gota, donde se disuelven más partículas de sólido hasta derretirse por completo. Mientras, en la sublimación se habla de una “burbuja”, de un vapor progresivo sin que moje la superficie que toque, sino que inmediatamente se deposita o cristaliza.
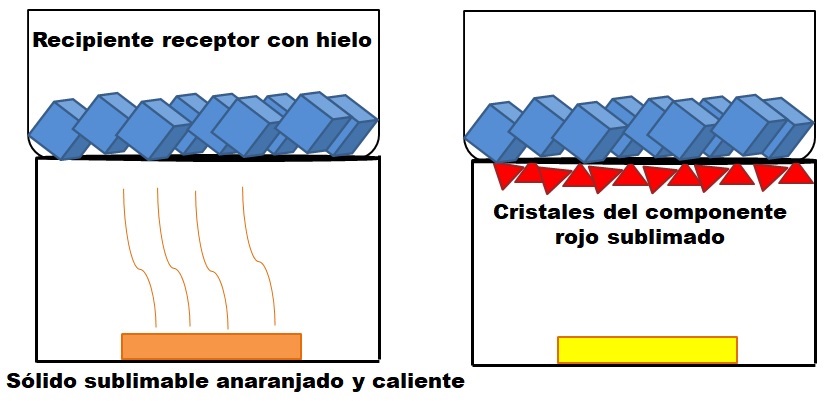
Lo descrito en el párrafo de arriba se representa en la imagen superior. Supóngase una mezcla sólida anaranjada (izquierda), la cual comienza a aumentar su energía mediante el incremento de la temperatura. El componente rojo sublima, para luego depositarse en el fondo del recipiente receptor, cuya temperatura es menor por tener cubos de hielo en su contenido.
Los triángulos o cristales rojos se depositan gracias a la superficie fría de este recipiente (derecha), el cual absorbe su temperatura; y aunque no se muestre, el tamaño de sus cubos de hielo debe disminuir debido a la absorción del calor. El sólido remanente posee un componente amarillo no sublimable en las condiciones del proceso.
Índice del artículo
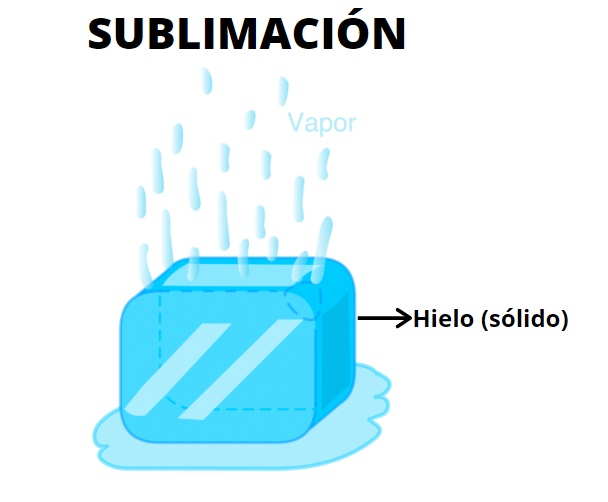
Ya se dijo que la sublimación es un cambio estado endotérmico, pues para que ocurra debe haber absorción de calor. Si el sólido absorbe calor su energía se incrementará, por lo que sus partículas vibrarán además a mayores frecuencias.
Cuando estas vibraciones se vuelven muy fuertes, terminan afectando las interacciones intermoleculares (no los enlaces covalentes); y en consecuencia, más tarde o temprano las partículas tomarán más distancias unas de otras, hasta que logren fluir y desplazarse más libremente por las regiones del espacio.
En algunos sólidos las vibraciones son tan fuertes, que algunas partículas salen “disparadas” fuera de la estructura en lugar de aglomerarse en cúmulos móviles que definen una gota. Estas partículas se escapan e integran la primera “burbuja”, que más bien vendrían a conformar los primeros vapores del sólido sublimado.
Se habla entonces no de un punto de fusión, sino de uno de sublimación. Si bien ambos son dependientes de la presión reinante sobre el sólido, lo es más el punto de sublimación; por lo tanto, su temperatura varía notablemente con los cambios de presión (al igual que como sucede con el punto de ebullición).
En la sublimación también se dice que hay un incremento de la entropía del sistema. Los estados energéticos de las partículas pasan de estar limitados por sus posiciones fijas en la estructura sólida, a homogeneizarse en sus rumbos caprichosos y caóticos en el estado gaseoso, más uniforme, donde finalmente adquirieren una energía cinética promedio.
El punto de sublimación depende de la presión; porque de lo contrario, las partículas del sólido absorberían calor no para salir disparadas al espacio fuera del sólido, sino para formar gotas. No se sublimaría, sino que se derretiría o fundiría, como es lo más usual.
Mientras más grande sea la presión externa, menos probable será la sublimación, ya que se obliga al sólido a fundirse.
Pero, ¿cuáles sólidos son sublimables y cuáles no? La respuesta reside en sus diagramas de fases P vs T, como el mostrado abajo:
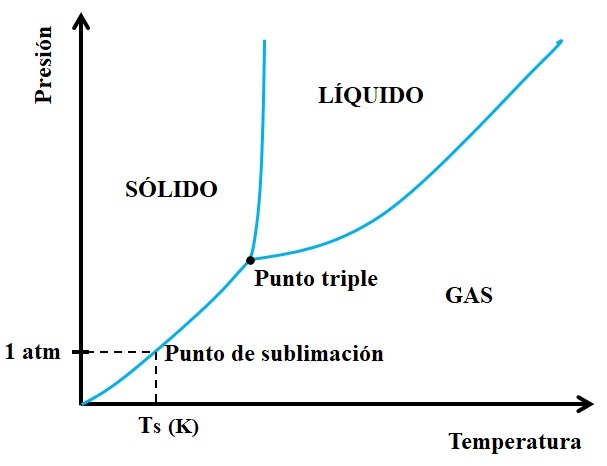
Hay que mirar primero al punto triple y recorrer el tramo inferior: el que separa los estados sólido y gaseoso. Nótese que en la región del sólido, debe haber un descenso de la presión para que la sublimación ocurra (no necesariamente a 1 atm, nuestra presión atmosférica). A 1 atm, la sustancia hipotética sublimará a una temperatura Ts expresada en K.
Mientras más largo y horizontal sea el tramo o la curva debajo del punto triple, mayor será la capacidad del sólido a sublimarse a distintas temperaturas; pero si está muy por debajo de 1 atm, entonces se necesitará de altos vacíos para lograr la sublimación, de tal modo que se disminuyan las presiones (0,0001 atm, por ejemplo).
Si el punto triple se encuentra miles de veces más bajo que la presión atmosférica, el sólido nunca sublimará ni aun aplicando ultravacío (sin mencionar su susceptibilidad a descomponerse por la acción del calor).
Si este no es el caso, las sublimaciones se realizan calentando moderadamente, y sometiendo el sólido a vacío para que sus partículas escapen con mayor facilidad, sin necesidad de que absorban tanto calor.
La sublimación se vuelve muy importante cuando se tratan especialmente de sólidos con una alta presión de vapor; es decir, la presión en su interior, reflejo de la eficiencia de sus interacciones. Mientras mayor sea su presión de vapor, más oloroso es, y también más sublimable.
La imagen del sólido anaranjado y su componente rojizo sublimable es un ejemplo de lo que representa la sublimación en lo concerniente a la purificación de sólidos. Los triángulos rojos pueden volver a resublimarse las veces que hagan falta hasta que se le garantice una alta pureza.
Esta técnica se utiliza sobre todo con los sólidos fragantes. Por ejemplo: alcanfor, cafeína, benzoína y mentol.
Entre otros sólidos que pueden someterse a sublimación tenemos: yodo, hielo (en grandes altitudes), teobromina (del chocolate), sacarina, morfina y otras drogas, bases nitrogenadas y antraceno.
Regresando a los triángulos rojos, la sublimación ofrece una alternativa a la cristalización convencional; ya no se sintetizarán cristales a partir de una disolución, sino mediante la deposición lo más controlada posible de vapores sobre una superficie fría, donde convenientemente puede haber semillas cristalinas para favorecer una morfología en específico.
Digamos, si se tienen cuadrados rojos, el crecimiento de los cristales mantendrá esta geometría y no deberían tornarse triangulares. Los cuadrados rojos irán creciendo paulatinamente conforme transcurra la sublimación. No obstante, se trata de un complejo operacional y molecularmente complejo, en el que se ven muchas variables implicadas.
Ejemplos de cristales sintetizados vía sublimación son: carburo de silicio (SiC), grafito, arsénico, selenio, fósforo, nitruro de aluminio (AlN), sulfuro de cadmio (CdS), seleniuro de cinc (ZnSe), yoduro de mercurio (HgI2), grafeno, entre otros.
Nótese que realmente se tratan de dos fenómenos compenetrados: sublimación progresiva y deposición (o sublimación inversa); el vapor emigra del sólido a regiones o superficies más frías, para finalmente depositarse en forma de cristales.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2019). Sublimation (phase transition). Recuperado de: en.wikipedia.org
- Jones, Andrew Zimmerman. (27 de enero de 2019). Sublimation. Recuperado de: thoughtco.com
- Sheila Morrissey. (2019). What is Sublimation in Chemistry? – Definition, Process & Examples. Study. Recuperado de: study.com
- Elsevier B.V. (2019). Sublimation Method. ScienceDirect. Recuperado de: sciencedirect.com
