Equilibrio líquido-vapor: sustancias puras, mezclas, aplicaciones
¿Qué es el equilibrio líquido-vapor?
El equilibrio líquido-vapor es un estado dinámico que establece un líquido, sea una sustancia pura o una mezcla, con el vapor que rodea e interacciona con su superficie. Para que tome lugar el recipiente debe estar cerrado, pues de lo contrario las corrientes de aire ocasionarían que el líquido se evaporase lentamente.
Cuando el sistema está cerrado, la presión que ejercen las moléculas en fase de vapor contra el líquido irá escalando conforme transcurre el tiempo. Llegará un punto en el que la presión se detendrá; esta es la presión de vapor del líquido, el cual es una propiedad física de la materia, siendo independiente del tamaño del recipiente, o del volumen de líquido.

Todo líquido, puro o mixto, tendrá una presión de vapor asociada que dependerá de la volatilidad de sus componentes; y por consiguiente, de las fuerzas intermoleculares que los mantienen unidos en el seno del líquido y sobre su superficie.
Esta presión puede describirse asumiendo la idealidad de las soluciones, o la miscibilidad de los componentes de una mezcla. Para ello, resulta de mucha utilidad el uso de los diagramas binarios, en los cuales es posible contemplar la viabilidad de un proceso de separación.
El equilibrio líquido-vapor es imprescindible para infinidades de procesos de ingeniería química, tales como las destilaciones fraccionadas y aquellas realizadas con vapor de agua, mediante las cuales se obtienen destilados ricos en los componentes más volátiles. Es el caso del etanol al 95.4% en agua, siendo el porcentaje de alcohol más accesible y económico en el mercado.
Sustancias puras
Las moléculas de una sustancia pura A no están quietas, sino que se desplazan de un lugar a otro gracias a una energía cinética intrínseca. Esta energía puede ser en ocasiones lo suficiente grande para vencer las fuerzas intermoleculares que “jalan” una molécula de A en particular hacia el seno del líquido. Entonces, la molécula A escapará de la superficie del líquido hacia la fase de vapor.
En la fase de vapor, las moléculas colisionarán contra las paredes internas del recipiente, ganando o perdiendo velocidad hasta reencontrarse con la superficie del líquido, donde una vez pasan a integrar el conglomerado de moléculas de la fase líquida.
Así, va transcurriendo el tiempo hasta que, a una determinada temperatura (a decir 25 ºC), el número de moléculas que escapan de la superficie iguala a las que entran desde el vapor. Se dice por lo tanto que se ha establecido un equilibrio líquido-vapor en una sustancia pura A.
La presión de vapor de A que experimentan las paredes internas del recipiente, así como la superficie del líquido, será igual a PAº, la cual es constante y reproducible; sin importar cuán grande o pequeño sea el recipiente, ni tampoco el volumen del líquido A considerado.
Mezclas
En las mezclas líquidas también habrá un componente que ejerza presión sobre la superficie del líquido y los contornos del recipiente. Su presión de vapor, como puede esperarse, estará compuesta por contribuciones de cada uno de los componentes de la mezcla, a decir, dos sustancias A y B. Estas mezclas pueden ser miscibles, parcialmente miscibles, o inmiscibles.
Miscibles
En una mezcla miscible entre A y B, ambas sustancias componen una sola fase, que a simple vista luce como una sustancia pura. Así, de acuerdo a la ley de Dalton, la presión de la mezcla o solución será igual a:
Psol = PA + PB +··· Pi
Siendo Pi cualquier otro componente que también esté presente en la mezcla. Nótese que PA≠PAº, es decir, que las presiones de las sustancias en la mezcla no son iguales que las de sus estados de alta pureza.
Al asumirse que la solución es ideal, se obvia las diferencias entre las interacciones A-A, B-B y A-B. Esto puede aplicarse, por ejemplo, en una mezcla de etanol y metanol.
Por lo tanto, las presiones de vapor de los componentes en la mezcla dependerán de sus cantidades relativas en la fase líquida, expresadas como fracciones molares Xi. Y es aquí donde interviene la ley de Raoult, la cual busca relacionar la presión PA y PAº:
PA = XA PAº
Siendo ahora la presión total igual a:
Psol = XA PAº + XB PBº +···
La fase de vapor, por otro lado, tendrá sus propias composiciones, expresadas como fracciones molares Yi:
Yi = Pi / Psol
= Xi Piº / Psol
Diagrama binario
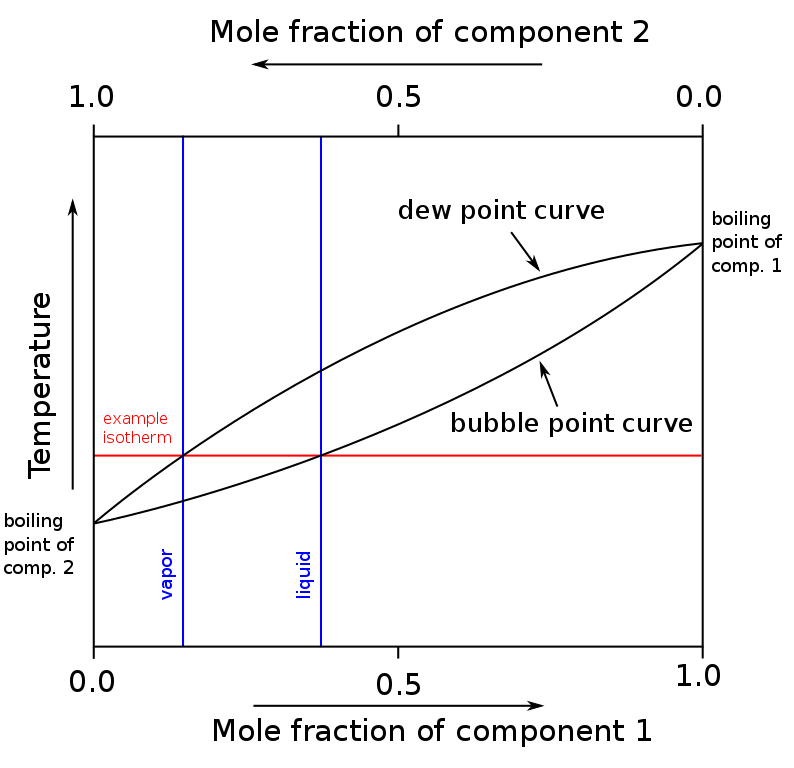
Cuando se grafican las fracciones molares de los componentes de una mezcla binaria (A + B), en función de la temperatura o la presión, se obtienen diagramas binarios (ver arriba). Esta forma en particular, la más simple, corresponde al de las soluciones ideales.
El área por encima del “óvalo” corresponde a la fase de vapor, mientras que el área por debajo corresponde a la fase líquida de la mezcla. Nótese que cuando la fracción molar del componente 1 o A es 0 (X1=0), la fracción molar del componente 2 o B será igual a 1 (X2=1), y entonces la presión de vapor se deberá únicamente a B. Esta temperatura viene a ser la del punto de ebullición de B.
Mientras, en el otro extremo (derecho), cuando X2=0 pero X1=1, la presión de vapor se deberá únicamente a A. Esta temperatura viene a ser la de su punto de ebullición.
La línea inferior del óvalo corresponde al punto de burbuja, que es cuando aparece la primera burbuja al calentarse la mezcla líquida (yendo hacia arriba en el diagrama). Y la línea superior, corresponde al punto de rocío, que es cuando se enfría la fase de vapor y aparece la primera gota (yendo hacia abajo en el diagrama).
Azeótropos
En muchas soluciones no ideales tendremos azeótropos, los cuales son mezclas que se evaporan manteniendo constante su composición; es decir, se evaporan como si se trataran de un compuesto puro.
Es imposible “romper” una composición azeotrópica mediante más pasos de destilaciones. En su lugar, se recurre a otros métodos para aumentar la pureza del componente deseado.
Por ejemplo, la mezcla etanol-agua forma un azeótropo con una composición de 95.4 de etanol. Esto quiere decir que es imposible, mediante destilaciones, obtener un etanol con una concentración superior al 95.4%; siempre habrá 4.6% de agua restante. Si se quisiera preparar etanol absoluto (100%), se requeriría del uso de materiales deshidratantes, o de otras rutas de síntesis.
En un diagrama binario podemos ver la presencia de un azeótropo, el cual presenta la siguiente forma:
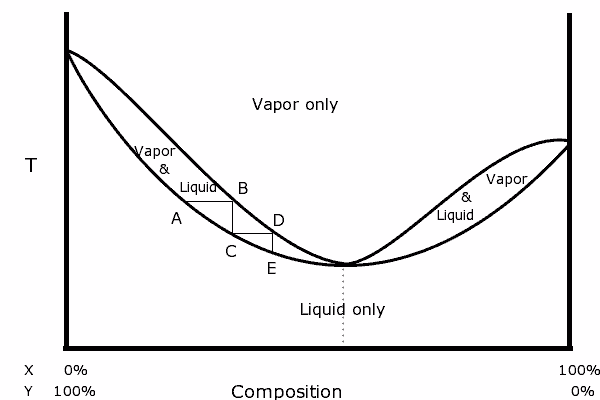
A la izquierda del diagrama puede verse que dentro del “óvalo”, región donde tenemos el equilibrio líquido-vapor, podemos ir destilando en pasos consecutivos (A, B, C, D y E) para ir obteniendo una mezcla cada vez más rica en el componente más volátil (X para este diagrama).
En el punto azeotrópico, sin embargo, la mezcla X y Y hervirá como si fuera una sola sustancia, por lo que no importa cuántas destilaciones se realicen, tanto el líquido como el vapor tendrán la misma composición.
Parcialmente miscibles
En las mezclas parcialmente miscibles se formarán, dependiendo de la temperatura, dos fases reconocibles: una rica en el componente A, y otra rica en el componente B. Los diagramas binarios para estos casos son muchos más rigurosos y amplios, pues involucran regiones donde coexiste el vapor junto con las dos fases.
Inmiscibles
Cuando se habla de mezclas inmiscibles, cada componente se comportará como si estuviera en un estado de alta pureza, ya que apenas interacciona con las demás moléculas. Por lo tanto, la presión de vapor para estas mezclas será igual a:
Psol = PAº + PBº +··· Piº
La mezcla hervirá a una temperatura inferior a la de los componentes puros, debido a que la presión de la mezcla inmiscible será más alta, pues es igual a la sumatoria de las presiones de cada componente en su estado puro. Más presión de vapor, implica que es más volátil, y por ende hervirá a menor temperatura.
Aplicaciones
Destilaciones
En las destilaciones, sobre todo a nivel industrial, resulta primordial el conocimiento sobre el equilibrio líquido-vapor. A partir de los componentes de la mezcla, y de sus diagramas de fase, puede calcularse cuántos platos se necesita en la construcción de una torre de fraccionamiento para la correcta separación de dichos componentes.
Destilación con vapor de agua
El vapor de agua puede bombearse dentro de una mezcla sometida a destilación. Al burbujear el vapor de agua dentro del seno del líquido, se incrementará la presión de vapor de la mezcla, por lo que hervirá a una menor temperatura y ayudará a extraer los componentes más volátiles (tales como esencias).
Pájaro bebedor

Aunque no se trate precisamente de un equilibrio líquido-vapor, lo cierto es que detrás del funcionamiento del pájaro bebedor se esconden varios fenómenos termodinámicos.
Cuando se moja la cabeza del pájaro, comienza a enfriarse conforme el agua se evapora. Este descenso de temperatura ocasiona una disminución de presión dentro de la cabeza del pájaro. El cloruro de metileno, ubicado en la base del pájaro, buscará balancear las presiones, fluyendo hacia arriba a través de un tubo de vidrio que conecta la cabeza con la cabeza.
El líquido ascenderá hacia la cabeza del pájaro, volviéndola más pesada e inclinando su cuerpo hacia adelante. El pájaro entonces “beberá agua” y las presiones de vapor se equilibrarán. Balanceadas las presiones, el cuerpo del pájaro regresará a la posición vertical y el ciclo se repetirá mientras el agua de la cabeza vuelve a evaporarse.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Walter J. Moore. (1962). Physical Chemistry. (Cuarta edición). Longmans.
- Wikipedia. (2020). Vapor–liquid equilibrium. Recuperado de: en.wikipedia.org
- Ed Vitz et al. (05 de noviembre de 2020). Vapor-Liquid Equilibrium. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Limer Eric. (30 de enero de 2018). An Absurdly Detailed Explanation of the Drinking Bird Toy. Recuperado de: popularmechanics.com
- Universidad de Alicante. (s.f.). TEMA 4: Cálculo del equilibriolíquido-vapor. Diagramas de equilibrio. [PDF]. Recuperado de: rua.ua.es
