Ácido cítrico: qué es, fuentes, estructura, producción, propiedades, usos

¿Qué es el ácido cítrico?
El ácido cítrico es un compuesto orgánico que consiste en un ácido débil cuya fórmula química es C6H8O7. Una de sus principales fuentes naturales son las frutas cítricas, y asimismo deriva de la palabra en latín citrus, que significa amargo.
No solo es un ácido débil, sino que además es poliprótico, es decir, puede liberar más de un ion hidrógeno, H+. Precisamente, se trata de un ácido tricarboxílico, por lo que tiene tres grupos –COOH donadores de iones H+. Cada uno de ellos tiene su propia tendencia de liberarse hacia su entorno.
Por lo tanto, su fórmula estructural queda mejor definida como C3H5O(COOH)3. Esta es la razón química por la que debe su aporte el sabor característico de, por ejemplo, una naranja.
¿Dónde se encuentra el ácido cítrico?
El ácido cítrico se encuentra en bajas proporciones en todas las plantas y animales, y es un metabolito de los seres vivos. Es un compuesto intermediario del metabolismo aeróbico presente en el ciclo de los ácidos tricarboxílicos o ciclo del ácido cítrico.
En biología o bioquímica este ciclo también es conocido como el ciclo de Krebs, una ruta anfibólica del metabolismo.
Además de encontrarse naturalmente en plantas y animales, este ácido es obtenido de forma sintética a gran escala mediante la fermentación.
Es muy usado en la industria de los alimentos, en la farmacéutica y química, y se comporta como un conservante natural. Él y sus derivados se fabrican masivamente a nivel industrial para dar sabor a alimentos sólidos y líquidos.
Encuentra uso como aditivo en variedades de productos de belleza para la piel, también se emplea como agente quelante, acidificante y antioxidante. No se recomienda, sin embargo, su uso en concentraciones elevadas o puras, ya que puede causar irritación, alergias e, incluso, cáncer.
Estructura del ácido cítrico
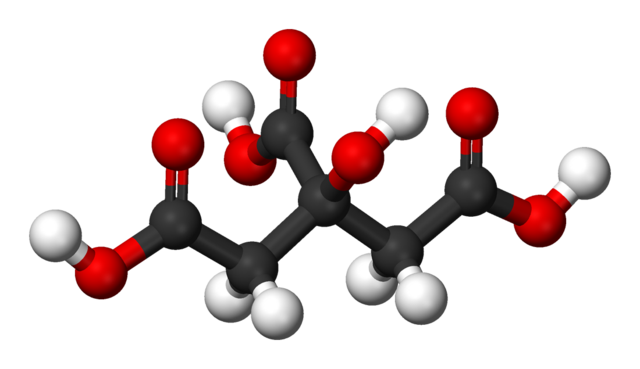
En la imagen superior se representa la estructura del ácido cítrico con un modelo de esferas y barras. Si se observa con atención, podrá hallarse el esqueleto de apenas tres carbonos: propano.
El átomo de carbono del centro está enlazado a un grupo –OH, el cual ante la presencia de grupos carboxilos, –COOH, adopta la terminología ‘hidroxi’. Los tres grupos –COOH son fácilmente reconocibles en los extremos izquierdo y derecho, y en la parte superior de la estructura. Son de estos donde se liberan los H+.
Por otro lado, el grupo –OH también es capaz de perder un protón ácido, por lo que en total no serían tres H+, sino cuatro. No obstante, este último requiere de una base considerablemente fuerte, y en consecuencia, su aporte a la acidez característica del ácido cítrico es mucho menor comparada a la de los grupos –COOH.
De todo lo anterior se deduce que al ácido cítrico también puede llamársele: 2-hidroxi-1,2,3-propano tricarboxílico.
Hay un grupo –OH en el C-2, el cual está adyacente al grupo –COOH (mirar el centro superior de la estructura). Debido a esto, el ácido cítrico también entra en la clasificación de alfa-hidroxiácidos, donde alfa significa ‘adyacente’, es decir, solo hay un átomo de carbono separando al –COOH y –OH.
Propiedades físicas y químicas del ácido cítrico
Peso molecular
210.14 g/mol.
Apariencia física
Cristales ácidos incoloros e inodoros.
Sabor
Ácido y amargo.
Punto de fusión
153° C.
Punto de ebullición
175° C.
Densidad
1,66 g/mL.
Solubilidad
Es un compuesto altamente soluble en agua. Asimismo, es muy soluble en otros solventes polares, como el etanol y el etil acetato. En solventes apolares y aromáticos como el benceno, tolueno, cloroformo y xileno, es insoluble.
pKa
-3,1
-4,7
-6,4
Estos son los valores de los pKa para cada uno de los tres grupos –COOH. Nótese que el tercer pKa (6,4) apenas es ligeramente ácido, por lo que se disocia poco.
Descomposición
A temperaturas extremas o superiores a los 175° C se descompone liberando CO2 y agua. Por lo tanto, el líquido no alcanza a hervir significativamente ya que se descompone primero.
Derivados
A medida que pierde H+, otros cationes ocupan su lugar pero de manera iónica, es decir, las cargas negativas de los grupos –COO– atraen otras especies de cargas positivas, como el Na+. Mientras más desprotonado esté el ácido cítrico, más cationes tendrán sus derivados llamados citratos.
Un ejemplo es el citrato de sodio, el cual presenta un efecto quelante muy útil como coagulante. Estos citratos, por tanto, pueden formar complejos con metales en solución.
Por otro lado, los H+ de los grupos –COOH pueden incluso llegar a sustituirse por otras especies enlazadas covalentemente, como cadenas laterales R, dando origen a los ésteres de citrato: C3H5O(COOR)3.
La diversidad es muy grande, ya que no todos los H deben estar necesariamente sustituidos por R, sino además por cationes.
Producción
El ácido cítrico puede ser producido de forma natural y a nivel comercial obtenido por la fermentación de los carbohidratos. Su producción también se ha realizado de forma sintética mediante procesos químicos que no se mantienen muy vigentes en la actualidad.
Se han utilizado varios procesos biotecnológicos para su producción, ya que este compuesto tiene una alta demanda a nivel mundial.
Síntesis química o sintética
– Uno de estos procesos de síntesis química es realizado en condiciones de alta presión a partir de sales de calcio de isocitrato. El jugo extraído de las frutas cítricas es tratado con hidróxido de calcio, y se obtiene el citrato de calcio.
Luego esta sal se extrae y se le hace reaccionar con una solución diluida de ácido sulfúrico, cuya función consiste en protonar el citrato a su forma ácida original.
– También el ácido cítrico ha sido sintetizado a partir de la glicerina reemplazando componentes de la misma por un grupo carboxilo. Como acaba de mencionarse, estos procesos no son óptimos para la producción del ácido cítrico a gran escala.
Natural
En el organismo, el ácido cítrico se produce de forma natural en el metabolismo aeróbico: ciclo de los ácidos tricarboxílicos. Cuando la acetil coenzima A (acetil-CoA) entra al ciclo se une con el ácido oxaloacético, forma ácido cítrico.
En las reacciones del catabolismo de los ácidos grasos, de los carbohidratos, entre otros sustratos, en presencia de O2 se produce acetil-CoA. Este se forma como producto de la beta-oxidación de los ácidos grasos, de la transformación del piruvato generado en la glucólisis.
El ácido cítrico formado en el ciclo de Krebs o ciclo del ácido cítrico, será oxidado a ácido alfa-cetoglutárico. Este proceso representa una ruta anfibólica de óxido-reducción, de la cual se generan equivalentes que producirán luego energía o ATP.
No obstante, tampoco ha resultado rentable ni satisfactoria la producción comercial del ácido cítrico como intermediario del metabolismo aeróbico. Solo bajo condiciones de desequilibrio orgánico se puede elevar la concentración de este metabolito, lo cual no resulta viable para los microorganismos.
Por fermentación
Los microorganismos, como los hongos y bacterias, producen ácido cítrico al fermentar los azúcares.
La producción del ácido cítrico a partir de la fermentación microbiana ha rendido mejores frutos que la obtención por síntesis química. Se han desarrollado líneas de investigación relacionadas con este método de producción comercial masivo, el cual ha ofrecido grandes ventajas económicas.
Las técnicas de cultivo a nivel industrial han variado con el transcurrir del tiempo. Se han empleado cultivos para fermentación en superficie y sumergidos. Los cultivos sumergidos son aquellos en los cuales los microorganismos producen la fermentación a partir de sustratos contenidos en medios líquidos.
Han resultado óptimos los procesos de producción del ácido cítrico por fermentación sumergida, el cual se produce en condiciones anaeróbicas.
Algunos hongos, como Aspergillus niger, Saccahromicopsis sp, y bacterias como Bacillus licheniformis, han permitido obtener un elevado rendimiento con este tipo de fermentación.
Los hongos como Aspergillus niger o candida sp, producen ácido cítrico como resultado de la fermentación de la melaza y el almidón. También se emplean como sustratos de la fermentación el azúcar de la caña, del maíz, de la remolacha, entre otros.
Usos del ácido cítrico
En la industria de los alimentos
– El ácido cítrico es empleado principalmente en la industria de los alimentos, ya que les aporta un agradable sabor ácido. Es muy soluble en agua, por lo que se agrega a bebidas, dulces, caramelos, gelatinas y a frutas congeladas. Asimismo, se emplea en la preparación de vinos y cervezas, entre otras bebidas.
– Además de agregar un sabor ácido, inactiva elementos traza dando protección al ácido ascórbico o vitamina C. También actúa como emulsionante en helados y quesos. Contribuye a la inactivación de enzimas oxidativas al disminuir el pH de los alimentos.
– Incrementa la efectividad de los conservantes agregados a los alimentos. Al proporcionar un pH relativamente bajo, disminuye la probabilidad de que sobrevivan microorganismos en los alimentos procesados, aumentando por lo tanto su vida útil.
– En grasas y aceites, el ácido cítrico se emplea para reforzar el efecto sinérgico (del conjunto de componentes grasos) antioxidante que puede tener este tipo de nutrientes.
En la industria farmacéutica
– También el ácido cítrico es ampliamente utilizado como excipiente en la industria farmacéutica para mejorar el sabor y disolución de los medicamentos.
– En combinación con el bicarbonato, el ácido cítrico se agrega a productos en polvo y en tabletas de manera que actúa como efervescente.
– Las sales del ácido cítrico permiten su empleo como anticoagulante, ya que tiene la capacidad de quelar el calcio. El ácido cítrico es administrado en suplementos de minerales como sales de citrato.
– El ácido cítrico al acidificar el medio del proceso de absorción a nivel intestinal optimiza la captación de vitaminas y algunos medicamentos. Su forma anhidra es administrada como coadyuvante de otros fármacos en la disolución de los cálculos.
– También es usado como acidificante, astringente, como agente que facilita la disolución de los ingredientes activos de varios productos farmacéuticos.
En la industria cosmética y en general
– En los productos para el aseo y cosméticos, el ácido cítrico se emplea como agente quelante de iones metálicos.
– Se usa para la limpieza y pulido de los metales en general, removiendo el óxido que les cubre.
– A bajas concentraciones sirve como aditivo en productos de limpieza ecológicos, que resultan benignos para el ambiente y la naturaleza.
– Tiene gran variedad de usos: se emplea en reactivos fotográficos, textiles, en el curtido de cuero.
– Se agrega a tintas de impresión.
Toxicidad
Los reportes de su toxicidad se asocian a una elevada concentración del ácido cítrico, al tiempo de exposición, impurezas, entre otros factores.
Las soluciones de ácido cítrico que se encuentran diluidas no representan ningún riesgo o peligro para la salud. Sin embargo, el ácido cítrico puro o concentrado sí constituye un peligro para la seguridad, y por lo tanto, no debe consumirse.
Puro o concentrado resulta corrosivo e irritante al contacto con la piel y mucosas de ojos, nariz y garganta. Puede ocasionar reacciones alérgicas en la piel, y una toxicidad aguda en caso de ingestión.
La inhalación del polvo del ácido cítrico puro puede igualmente afectar la mucosa de las vías respiratorias. Su inhalación puede ocasionar dificultad al respirar, alergias, ocasiona sensibilización de la mucosa respiratoria, e incluso puede desencadenar asma.
Se reportan efectos tóxicos para la reproducción. El ácido cítrico puede llegar a causar defectos genéticos, originando mutación en las células germinales.
Y finalmente, se considera peligroso o tóxico para el hábitat acuático, y en general, el ácido cítrico concentrado es corrosivo para los metales.
Referencias
- The Uses of Citric Acid in the Food Industry. Recuperado de bellchem.com
- Citric Acid. Recuperado de pubchem.ncbi.nlm.nih.gov
- Citric Acid. Recuperado de en.wikipedia.org
