Propiedades periódicas de los elementos y sus características
Las propiedades periódicas de los elementos son aquellas que definen su comportamiento físico y químico desde una perspectiva atómica, y cuyas magnitudes, además del número atómico, permiten una clasificación de los átomos.
De todas las propiedades, estas se caracterizan, como su nombre lo indica, por ser periódicas; esto es, si se estudia la tabla periódica se podrá certificar que sus magnitudes obedecen una tendencia que coincide y se repite con el ordenamiento de los elementos en períodos (filas) y grupos (columnas).

Por ejemplo, si se recorre un período y una propiedad periódica disminuye de magnitud con cada elemento, lo mismo le sucederá en todos los períodos. Por otro lado, si bajando por un grupo o columna incrementa su magnitud, puede esperarse que le suceda lo mismo para los otros grupos.
Y así, sus variaciones se repiten y evidencian una tendencia simple que concuerda con el ordenamiento de los elementos por sus números atómicos. Estas propiedades son directamente responsables del carácter metálico o no metálico de los elementos, así como de sus reactividades, lo cual ha ayudado a clasificarlos con mayor profundidad.
Si por un momento se desconociera la identidad de los elementos y se les viera como “esferas” extrañas, se podría volver a reconstruir (con mucho trabajo) la tabla periódica haciendo uso de estas propiedades.
De esta manera, las supuestas esferas adquirirían colores que permitirían diferenciarlas unas de otras en grupos (imagen superior). Conociendo sus características electrónicas, se podrían organizar en períodos, y los grupos delatarían aquellos que poseen el mismo número de electrones de valencia.
Aprender y razonar las propiedades periódicas es igual a saber por qué los elementos reaccionan de un modo u otro; es saber por qué los elementos metálicos están en ciertas regiones de la tabla, y los elementos no metálicos en otra.
Índice del artículo
Al observar las esferas de la imagen lo primero que puede notarse es que no todas tienen el mismo tamaño. Unas son más voluminosas que otras. Si se observa con mayor detenimiento, se encontrará que dichos tamaños varían obedeciendo un patrón: en un período disminuye de izquierda a derecha, y en un grupo aumenta de arriba hacia abajo.
Lo anterior también puede decirse de esta manera: el radio atómico decrece hacia los grupos o columnas de la derecha, y se incrementa en los períodos o filas inferiores. Siendo así, el radio atómico es la primera propiedad periódica, ya que sus variaciones siguen un patrón dentro de los elementos.
Carga nuclear vs electrones
¿A qué se debe este patrón? En un período los electrones del átomo ocupan un mismo nivel energético, el cual se relaciona con la distancia que los separa del núcleo. Cuando nos movemos de un grupo a otro (lo que es igual a recorrer el período hacia la derecha), el núcleo adiciona tanto electrones como protones dentro del mismo nivel energético.
Por lo tanto, los electrones no pueden ocupar distancias más alejadas del núcleo, el cual incrementa su carga positiva debido a que tiene más protones. En consecuencia, los electrones experimentan una mayor fuerza de atracción hacia el núcleo, atrayéndolos más y más a medida que aumenta el número de protones.
Es por eso que los elementos en el extremo derecho de la tabla periódica (columnas amarilla y turquesa) poseen los radios atómicos más pequeños.
Por otro lado, cuando se “salta” de un período a otro (lo que es igual a decir que se desciende por un grupo), los nuevos niveles de energía habilitados permiten que los electrones ocupen espacios más distantes del núcleo. Al estar más lejos, el núcleo (con más protones) los atrae con menor fuerza; y los radios atómicos por tanto se incrementan.
Radios iónicos
Los radios iónicos obedecen un patrón similar al de los radios atómicos; sin embargo, estos no dependen tanto del núcleo, sino de cuántos electrones demás o menos tiene el átomo respecto a su estado neutro.
Los cationes (Na+, Ca2+, Al3+, Be2+, Fe3+) exhiben una carga positiva porque han perdido uno o más electrones, y por tanto, el núcleo los atrae con mayor fuerza ya que hay menos repulsiones entre los mismos. El resultado: los cationes son más pequeños que los átomos del que derivan.
Y para los aniones (O2-, F–, S2-, I–) por el contrario, exhiben carga negativa porque tiene uno o más electrones en exceso, aumentando sus repulsiones entre sí por encima de la atracción que ejerce el núcleo. El resultado: los aniones son más grandes que los átomos del que derivan (imagen inferior).
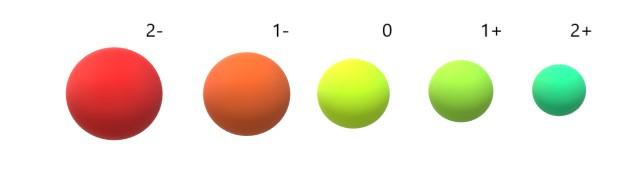
Se aprecia que el anión 2- es el más voluminoso de todos, y el catión 2+ el más pequeño. Los radios aumentan cuando el átomo se carga negativamente, y se contrae cuando se carga positivamente.
Cuando los elementos tienen radios atómicos pequeños, no solo sus electrones son atraídos con mucha fuerza, sino además, los electrones de los átomos vecinos cuando forma un enlace químico. Esta tendencia de atraer los electrones de otros átomos dentro de un compuesto es lo que se conoce como electronegatividad.
El que un átomo sea pequeño no significa que vaya a ser más electronegativo. Si así fuera, los elementos helio e hidrógeno serían los átomos más electronegativos. El helio hasta donde la ciencia ha demostrado, no forma enlace covalente de ningún tipo; y el hidrógeno, apenas tiene un único protón en el núcleo.
Cuando los radios atómicos son grandes, los núcleos no tienen suficiente fuerza para atraer los electrones de otros átomos; por lo tanto, los elementos más electronegativos son aquellos con un radio atómico pequeño y un mayor número de protones.
Nuevamente, los que cumplen estas características a la perfección son los elementos no metálicos del bloque p de la tabla periódica; estos son los pertenecientes al grupo 16 o del oxígeno (O, S, Se, Te, Po), y grupo 17 o del flúor (F, Cl, Br, I, At).
Tendencia
De acuerdo a todo lo dicho, los elementos más electronegativos se ubican especialmente en la esquina superior derecha de la tabla periódica; teniendo al flúor como el elemento que encabeza la lista de los más electronegativos.
¿Por qué? Sin recurrir a las escalas de electronegatividad (Pauling, Mulliken, etc.), el flúor si bien es más grande que el neón (el gas noble de su período), el primero sí puede formar enlaces mientras que el segundo no. Además, para su pequeño tamaño su núcleo tiene muchos protones, y donde esté el flúor, habrá un momento dipolar.
Si un elemento tiene un radio atómico en comparación a los de su mismo período, y es además poco electronegativo, se trata entonces de un metal, y presenta un carácter metálico alto.
Si volvemos a la imagen principal, las esferas rojizas y verdosas, al igual que las grisáceas, corresponden a elementos metálicos. Los metales tienen características únicas, y a partir de aquí empiezan a entrelazarse las propiedades periódicas con las propiedades físicas y macroscópicas de la materia.
Los elementos con alto carácter metálico se caracterizan por sus átomos relativamente grandes, fáciles de perder electrones ya que los núcleos apenas pueden atraerlos hacia ellos.
Como resultado, se oxidan o pierden electrones con facilidad para formar cationes, M+; esto no significa que todos los cationes sean metálicos.
Tendencia
A estas alturas se puede predecir cómo varía el carácter metálico en la tabla periódica. Si se sabe que los metales tienen radios metálicos grandes, y que además son pocos electronegativos, debe esperarse que los elementos más pesados (los períodos inferiores), sean los más metálicos; y los elementos más livianos (los períodos superiores), los menos metálicos.
Asimismo, el carácter metálico disminuye cuanto más electronegativo se haga el elemento. Esto quiere decir que recorriendo los períodos y grupos hacia la derecha de la tabla periódica, en sus períodos superiores, se encontrarán con los elementos menos metálicos.
Por lo tanto, el carácter metálico aumenta descendiendo por un grupo, y disminuye a izquierda a derecha en un mismo período. Entre los elementos metálicos tenemos: Na (sodio), Li (litio), Mg (magnesio), Ba (bario), Ag (plata), Au (oro), Po (polonio), Pb (plomo), Cd (cadmio), Al (aluminio), etc.
Si un átomo tiene un radio atómico grande, es de esperarse que su núcleo no mantenga atrapado con considerable fuerza a los electrones en las capas más externas. En consecuencia, eliminarlos del átomo en fase gaseosa (individualizados) no requerirá de mucha energía; esta es, la energía de ionización, EI, necesaria para quitarles un electrón.
EI también equivale a decir que es la energía que debe suministrarse para vencer la fuerza de atracción del núcleo de un átomo o ion gaseoso sobre su electrón más externo. Mientras más pequeño sea el átomo y más electronegativo, menor será su EI; esta es su tendencia.
La siguiente ecuación ilustra un ejemplo:
Na(g) => Na+(g) + e–
La EI necesaria para lograr esto no es tan grande en comparación a la segunda ionización:
Na+(g) => Na2+(g) + e–
Ya que en Na+ predominan las cargas positivas y el ion es más pequeño que el átomo neutro. En consecuencia, el núcleo de Na+ atrae con una fuerza mucho mayor a los electrones, por lo que requiere de una EI mucho más grande.
Y por último, está la propiedad periódica de la afinidad electrónica. Esta es la tendencia energética que tiene el átomo de un elemento en fase gaseosa por aceptar un electrón. Si el átomo es pequeño y posee un núcleo con una grande fuerza de atracción, le será fácil aceptar el electrón, formando un anión estable.
Mientras más estable sea el anión respecto a su átomo neutro, mayor será su afinidad electrónica. No obstante, también entra en juego las repulsiones entre los mismos electrones.
El nitrógeno, por ejemplo, tiene mayor afinidad electrónica que el oxígeno. Esto se debe a que sus tres electrones 2p están desapareados y se repelen menos entre sí y al electrón entrante; mientras que en el oxígeno, hay un par de electrones apareados que ejercen mayor repulsión electrónica; y en el flúor, hay dos pares.
Es por esta razón que la tendencia en las afinidades electrónicas se dice que se normalizan a partir del tercer período de la tabla periódica.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Prof. Ortega Graciela M. (01 de abril de 2014). Propiedades periódicas de los elementos. Color abc. Recuperado de: abc.com.py
- Chemistry LibreTexts. (07 de junio de 2017). Periodic Properties of the Elements. Recuperado de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (02 de enero de 2019). The Periodic Properties of the Elements. Recuperado de: thoughtco.com
- Toppr. (s.f.). Periodic Properties of Elements. Recuperado de: toppr.com /
- Periodic properties of the Elements: A journey across the table is a journey through chemistry. [PDF]. Recuperado de: cod.edu
