Yoduro de potasio (KI): estructura, propiedades, obtención, usos, riesgos
El yoduro de potasio es un compuesto inorgánico formado por un ion potasio (K+) y un ion yoduro (I–). Su fórmula química es KI. Es un sólido cristalino blanco, de naturaleza iónica y es muy soluble en agua.
El KI permite realizar varias reacciones y análisis químicos y se emplea para medir la cantidad de ozono en la atmósfera. También se emplea en los equipos de análisis con rayos infrarrojos (IR).

El yoduro de potasio se agrega a la sal común de mesa para evitar que se produzca una deficiencia de yodo en las personas, ya que esto puede constituir un problema serio de salud.
Se usa como expectorante pues ayuda a que el moco pueda fluir fácilmente desde los canales respiratorios hacia el exterior. También sirve para tratar algunas infecciones por hongos y se utiliza en algunos cosméticos.
Es utilizado por los médicos veterinarios para curar animales de problemas similares a los de los humanos, como tos e infecciones cutáneas. Incluso se añade en muy pequeñas cantidades a los alimentos para animales.
Índice del artículo
El yoduro de potasio es un compuesto iónico formado por el catión potasio K+ y el anión yoduro I–, por lo tanto, entre ambos el enlace es iónico. El estado de oxidación del potasio es +1 y la valencia del yodo es -1.
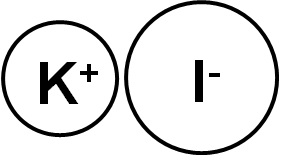
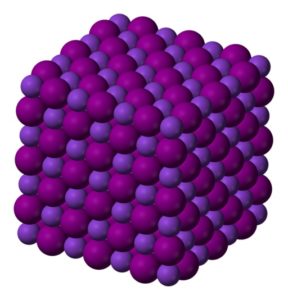
Los cristales de yoduro de potasio KI son cúbicos.
– Yoduro de potasio
– Yoduro potásico
Sólido incoloro a blanco cristalino. Cristales cúbicos.
166,003 g/mol
681 ºC
1323 ºC
3,13 g/cm3
Muy soluble en agua: 149 g/100 g de agua a 25 °C. Ligeramente soluble en etanol y en éter.
Sus soluciones acuosas son neutras o alcalinas, con pH entre 7 y 9.
Ligeramente higroscópico en aire húmedo.
Es estable en aire seco. La luz y la humedad aceleran su descomposición y su color cambia a amarillo debido a la liberación de pequeñas cantidades de yodo (I2) y yodatos (IO3–).
Las soluciones acuosas de KI también se vuelven amarillas con el tiempo, sin embargo, con un poco de álcali se puede evitar esto.
Estas soluciones disuelven al yodo (I2) dando KI3:
I– + I2 → I3–
Tiene sabor fuertemente amargo y salino. No es inflamable.
El yoduro de potasio se puede obtener calentando yodo (I2) en una solución concentrada de hidróxido de potasio (KOH):
3 I2 + 6 KOH → 5 KI + KIO3 + H2O
La solución de yodato y yoduro resultante es calentada para eliminar el agua, se reduce a sequedad, se agrega carbón y se calienta a alta temperatura. El carbón toma el oxígeno del yodato y se oxida a dióxido de carbono reduciendo así el yodato a yoduro:
2 KIO3 + C → 2 KI + 3 CO2
El yoduro de potasio obtenido se puede recristalizar para purificarlo. Es decir, se redisuelve en agua y se induce a cristalizar nuevamente.
El yoduro de potasio sirve como tratamiento adicional junto con otros agentes antitiroideos para tratar el hipertiroidismo.
El hipertiroidismo es una enfermedad que hace que la glándula tiroides produzca demasiada hormona tiroidea, con aumento de tamaño de la tiroides, disminución de peso de la persona, latidos acelerados del corazón e irritabilidad, entre otros síntomas.
En pacientes con hipertiroidismo el KI disminuye rápidamente los síntomas pues inhibe la liberación de la hormona tiroidea.
Sus efectos sobre la tiroides son: disminución de la cantidad de vasos sanguíneos de la glándula, reafirmación de sus tejidos y disminución del tamaño de sus células.
Por esta razón se aplica como tratamiento preoperatorio para inducir la involución o disminución de tamaño de la tiroides antes de una tiroidectomía (extirpación de la tiroides) pues así se facilita esta operación.
El yoduro de potasio posee propiedades expectorantes pues aumenta la secreción de fluidos respiratorios, resultando en disminución de la viscosidad del moco.

Sirve para el tratamiento del eritema nodoso, que es una inflamación dolorosa en las piernas en la que se forman nódulos enrojecidos y aumento de la temperatura.
Es un agente antihongos. Permite tratar la esporotricosis que es una infección de la piel causada por un hongo. Esta enfermedad le ocurre a personas que trabajan con plantas y tierra, como los agricultores y jardineros.
También se utiliza en el tratamiento de la deficiencia de yodo o para evitarla y por ello se agrega a la sal de mesa o sal comestible (cloruro de sodio NaCl) como fuente de yodo y en ocasiones en agua para beber.
El yoduro de potasio es administrado a animales como antitusivo, para aumentar y licuar los fluidos del tracto respiratorio, para la tos crónica bronquial, así como en casos de reumatismo y como antiinflamatorio.
También sirve para micosis (infecciones por hongos) de animales, para disminuir la picazón y para envenenamiento crónico con plomo o mercurio.
El yoduro de potasio tiene propiedades protectoras de la tiroides en el caso de que la persona haya estado expuesta a radiaciones nucleares.
El KI inunda la tiroides con yodo no radiactivo bloqueando así la toma de moléculas radiactivas y la absorción de yodo radiactivo, protegiendo la glándula tiroides del cáncer que puede causar la radiación.
El gas ozono (O3) puede medirse en la atmósfera utilizando celdas electrolíticas llamadas ozonosondas, las cuales son transportadas por globos de radiosondas.
Estas celdas electrolíticas contienen una solución de yoduro de potasio KI. Las celdas se encuentran inicialmente en equilibrio químico y eléctrico.
Cuando una muestra de aire con ozono (O3) penetra una de las celdas el equilibrio se rompe pues ocurre la siguiente reacción:
2 KI + O3 + H2O → I2 + O2 + 2 KOH
Esta reacción produce una corriente eléctrica que fluye entre las celdas.
La cantidad de corriente eléctrica producida se transmite continuamente por ondas de radio a una estación en tierra. De esta forma se obtiene el perfil de ozono que hay desde el suelo hasta la altura del balón.

El yoduro de potasio permite también:
– La eliminación de radicales libres como el radical hidroxilo OH.
– La manufactura de emulsiones fotográficas, para precipitar la plata.
– Mejorar la alimentación animal al ser añadido en microcantidades.
– Desodorizar el abono del ganado.
– Transmitir la luz del espectro infrarrojo en equipos de análisis IR.
– Realizar ciertas reacciones químicas y análisis en laboratorios de química.
– Utilizarlo en productos de higiene personal.
– Realizar análisis de contaminación ambiental.
Algunas personas sensibles a los yoduros deben tomarlo con precaución pues puede producir yodismo, o envenenamiento crónico con yodo, por ejemplo los que poseen una enfermedad autoinmune de la tiroides.
También deben tener cuidado las personas con tuberculosis o con bronquitis aguda.
El KI puede producir ablandamiento de las glándulas salivales, puede llegar a quemar la boca o garganta, aumento inusual de la salivación, dolor de dientes e inflamación de las encías y sabor metálico, entre otros síntomas.
Además puede irritar los ojos y las heridas abiertas en la piel.
- U.S. National Library of Medicine. (2019). Potassium iodide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fourth Edition. John Wiley & Sons.
- Dean, J.A. (editor). (1973). Lange’s Handbook of Chemistry. Eleventh Edition. McGraw-Hill Book Company.
- Valkovic, V. (2019). Decontamination after radiation exposure. Most sensitive body parts. In Radioactivity in the Environment (Second Edition). Recuperado de sciencedirect.com.
- Smit, H.G.J. (2015). Chemistry of the Atmosphere-Observations for Chemistry (In Situ). In Encyclopedia of Atmospheric Sciences (Second Edition). Recuperado de sciencedirect.com.
- Muralikrishna, I.V. and Manickam, V. (2017). Analytical Methods for Monitoring Environmental Pollution. In Environmental Management. Recuperado de sciencedirect.com.
- Wallace, J.M. and Hobbs, P.V. (2006). Atmospheric Chemistry 1. In Atmospheric Science (Second Edition). Recuperado de sciencedirect.com.
