Calor absorbido: fórmulas, cómo calcularlo y ejercicios resueltos
El calor absorbido se define como la transferencia de energía entre dos cuerpos a distintas temperaturas. El que tiene menor temperatura absorbe el calor del que está a mayor temperatura. Cuando esto sucede, aumenta la energía térmica de la sustancia que absorbe calor, y las partículas que la componen vibran con más rapidez, elevando su energía cinética.
Esto puede traducirse en un aumento de la temperatura o bien en un cambio de estado. Por ejemplo pasar de sólido a líquido, como el hielo cuando se derrite en contacto con el agua o el refresco a temperatura ambiente.

Gracias al calor, también es posible que los objetos cambien sus dimensiones. La dilatación térmica es un buen ejemplo de este fenómeno. Cuando la mayoría de las sustancias se calientan, suelen experimentar un aumento en sus dimensiones.
Una excepción a esto es el agua. Una misma cantidad de agua líquida aumenta su volumen al enfriarse por debajo de 4 ºC. Además, los cambios de temperatura también pueden experimentar cambios a nivel de su densidad, algo también muy observable en el caso del agua.
Índice del artículo
Tratándose de energía en tránsito, las unidades del calor absorbido son los Joules. Sin embargo, durante mucho tiempo el calor tuvo sus propias unidades: la caloría.
Todavía hoy en día esta unidad se utiliza para cuantificar el contenido energético de los alimentos, aunque en realidad una caloría alimentaria corresponde a una kilocaloría de calor.
La caloría, abreviada como cal, es la cantidad de calor necesaria para elevar en 1 º C la temperatura de 1 gramo de agua.
En el siglo XIX, Sir James Prescott Joule (1818 – 1889) llevó a cabo un famoso experimento en el que logró transformar trabajo mecánico en calor, obteniendo la siguiente equivalencia:
1 caloría = 4.186 Joules
En unidades británicas, la unidad de calor se llama Btu (British thermal unit), que se define como la cantidad de calor necesaria para elevar en 1 ºF la temperatura de una libra de agua.
La equivalencia entre unidades es la siguiente:
1 Btu = 252 calorías
El problema con estas unidades antiguas es que la cantidad de calor depende de la temperatura. Es decir, no es igual la que se requiere para pasar de 70 ºC a 75 ºC que la que se requiere para calentar el agua desde 9 ºC a 10 ºc, por ejemplo.
Por eso la definición contempla unos intervalos bien definidos: de 14.5 a 15.5°C y 63 a 64°F para la caloría y el Btu respectivamente.
¿De qué depende la cantidad de calor absorbida?
La cantidad de calor absorbido que recoge un material depende de varios factores:
– Masa. Cuanto mayor sea la masa, más cantidad de calor es capaz de absorber.
– Características de la sustancia. Existen sustancias que dependiendo de su estructura molecular o atómica, son capaces de absorber más calor que otras.
– Temperatura. Se requiere agregar más calor para obtener una temperatura más alta.
La cantidad de calor, denotada como Q, es proporcional a los factores descritos. Por lo tanto, se puede escribir como:
Q = m.c.ΔT
Donde m es la masa del objeto, c es una constante llamada calor específico, una propiedad intrínseca de la sustancia y ΔT es la variación de temperatura lograda al absorber el calor.
ΔT = Tf – To
Esta diferencia tiene signo positivo, ya que al absorber calor es de esperar que Tf > To. Esto ocurre a menos que la sustancia esté experimentando un cambio de fase, como por ejemplo el agua cuando pasa de líquido a vapor. Cuando el agua hierve, su temperatura se mantiene constante en aproximadamente 100 º C, sin importar cómo de rápido hierve.
Al poner en contacto dos objetos a diferente temperatura, después de un tiempo ambos llegan al equilibrio térmico. Entonces, las temperaturas se igualan y cesa la transferencia de calor. Lo mismo sucede si se ponen en contacto más de dos objetos. Tras un cierto tiempo, todos estarán a la misma temperatura.
Suponiendo que los objetos en contacto formen un sistema cerrado, del cual el calor no pueda escapar, el principio de la conservación de la energía se aplica, por lo que se puede afirmar que:
Q absorbido = – Q cedido
Esto representa un balance energético, semejante al de las entradas y los gastos de una persona. Por eso el calor cedido tiene signo negativo, ya que para el objeto que cede, la temperatura final es menor que la inicial. Por lo tanto:
ΔT = Tf – To 0
La ecuación Q absorbido = – Q cedido se utiliza siempre que se tengan dos objetos en contacto.
Para realizar el balance energético es necesario distinguir los objetos que absorben calor de los que ceden, entonces:
Σ Qk=0
Es decir, la suma de ganancias y pérdidas de energía en un sistema cerrado deben ser igual a 0.
El calor específico de una sustancia
Para calcular la cantidad de calor absorbido se necesita conocer el calor específico de cada sustancia participante. Se trata de la cantidad de calor necesaria para elevar en 1 º C la temperatura de 1 g de material. Sus unidades en el Sistema Internacional son: Joule/kg . K.
Existen tablas con el calor específico de numerosas sustancias, calculado generalmente mediante el uso de un calorímetro o herramientas similares.
Un ejemplo de cómo calcular el calor específico de un material
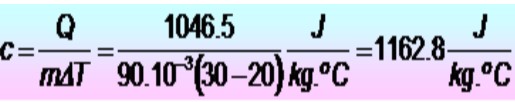
Se requieren 250 calorías para elevar la temperatura de un anillo metálico de 20 a 30 ºC. Si el anillo tiene una masa de 90 g. ¿Cuál es el calor específico del metal en unidades del SI?
Solución
Se convierten primero las unidades:
Q = 250 calorías = 1046.5 J
m = 90 g = 90 x 10-3 kg
Una taza de aluminio contiene 225 g de agua y un agitador de cobre de 40 g, todos a 27 °C. Una muestra de 400 g de plata a temperatura inicial de 87 °C se coloca en el agua.
El agitador se utiliza para agitar la mezcla hasta que alcanza su temperatura final de equilibrio de 32 °C. Calcule la masa de la taza de aluminio, considerando que no hay pérdidas de calor hacia el ambiente.
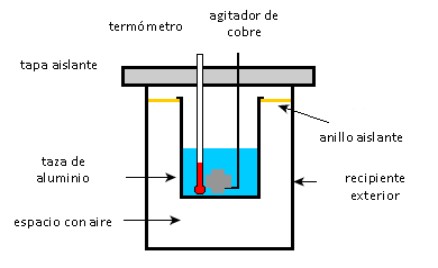
Como se dijo anteriormente, es importante distinguir los objetos que ceden calor de los que absorben:
– La taza de aluminio, el agitador de cobre y el agua absorben calor.
– La muestra de plata cede calor.
Se suministran los calores específicos de cada sustancia:
– Plata: c= 234 J/kg. ºC
– Cobre: c= 387 J/kg. ºC
– Aluminio c= 900 J/kg. ºC
– Agua c= 4186 J/kg. ºC
Se calcula el calor absorbido o cedido por cada sustancia mediante la ecuación:
Q = m.c.λT
Solución
Plata
Q cedido = 400 x 10 -3 . 234 x (32 – 87) J = -5148 J
Agitador de cobre
Q absorbido = 40 x 10 -3 . 387 x (32 – 27) J = 77.4 J
Agua
Q absorbido = 225 x 10 -3 . 4186 x (32 – 27) J = 4709.25 J
Taza de aluminio
Q absorbido = m aluminio . 900 x (32 – 27) J = 4500 .m aluminio
Haciendo uso de :
Σ Qk=0
77.4 + 4709.25 + 4500 .m aluminio = – (-5148)
Finalmente se despeja la masa del aluminio:
m aluminio = 0.0803 kg = 80.3 g
- Giancoli, D. 2006. Physics: Principles with Applications. 6th. Ed. Prentice Hall. 400 – 410.
- Kirkpatrick, L. 2007. Física: Una mirada al mundo. 6ta Edición abreviada. Cengage Learning. 156 – 164.
- Rex, A. 2011. Fundamentos de Física. Pearson. 309 – 332.
- Sears, Zemansky. 2016. University Physics with Modern Physics. 14th. Volume1. 556 – 553.
- Serway, R., Vulle, C. 2011. Fundamentos de Física. 9na Cengage Learning. 362 – 374
