Polaridad (química): moléculas polares y ejemplos
La polaridad química es una propiedad que se caracteriza por la presencia de una marcada distribución heterogénea de las densidades electrónicas en una molécula. En su estructura, por lo tanto, hay regiones cargadas negativamente (δ-), y otras cargadas positivamente (δ+), generando un momento dipolar.
El momento dipolar (µ) de enlace es una forma de expresión de la polaridad de una molécula. Se suele representar como un vector cuyo origen se encuentra en la carga (+) y su fin está ubicado en la carga (-), aunque algunos químicos lo representan en forma inversa.
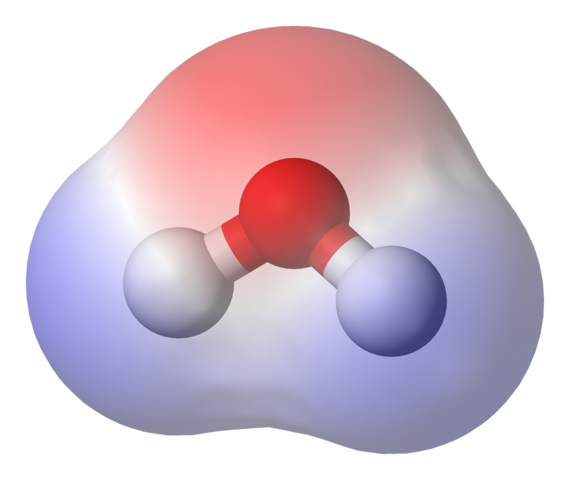
En la imagen superior se muestra el mapa de potencial electrostático para el agua, H2O. La región rojiza (átomo de oxígeno) corresponde a la de mayor densidad electrónica, y además puede verse que esta resalta sobre las regiones azules (átomos de hidrógeno).
Como la distribución de dicha densidad electrónica es heterogénea, se dice que hay un polo positivo y otro negativo. Es por eso que se habla de ‘polaridad’ química, y de momento dipolar.
Índice del artículo
El momento dipolar µ viene definido por la siguiente ecuación:
µ = δ·d
Donde δ es carga eléctrica de cada polo, positivo (+δ) o negativo (–δ), y d es la distancia entre ellos.
El momento dipolar suele ser expresado en debye, representado por el símbolo D. Un coulomb·metro equivale a 2,998·1029 D.
El valor del momento dipolar del enlace entre dos átomos diferentes, está en relación a la diferencia de electronegatividades de los átomos que forman el enlace.
Para que una molécula sea polar no basta con tener en su estructura enlaces polares, sino que además debe tener una geometría asimétrica; de tal manera, que impida que los momentos dipolares se anulen vectorialmente entre sí.
La molécula de agua tiene dos enlaces O-H. La geometría de la molécula es angular, es decir, con forma de “V”; por lo que los momentos dipolares de los enlaces no se anulan entre sí, sino que se produce la suma de ellos apuntando hacia el átomo de oxígeno.
El mapa de potencial electrostático para el H2O refleja esto.
Si se observa la molécula angular H-O-H, puede surgir la siguiente pregunta: ¿realmente es asimétrica? Si se traza un eje imaginario que atraviese el átomo de oxígeno, la molécula se dividirá en dos mitades iguales: H-O|O-H.
Pero, no es así si el eje imaginario es horizontal. Cuando este eje ahora divide la molécula nuevamente en dos mitades, se tendrá por un lado el átomo de oxígeno, y por el otro los dos átomos de hidrógeno.
Ya por esto la aparente simetría del H2O deja de existir, y se considera por lo tanto una molécula asimétrica.
Las moléculas polares deben cumplir con una serie de características, tales como:
-Distribución de las cargas eléctricas en la estructura molecular es asimétrica.
-Suelen ser solubles en el agua. Esto se debe entre moléculas polares pueden interactuar por fuerzas dipolo-dipolo, donde el agua se caracteriza por tener un momento dipolar grande.
Además, su constante dieléctrica es muy alta (78,5), lo que le permite mantener las cargas eléctricas separadas aumentando su solubilidad.
-En general, las moléculas polares presentan altos puntos de ebullición y fusión.
Estas fuerzas están constituidas por la interacción dipolo-dipolo, las fuerzas dispersivas de London y la formación de puentes de hidrógeno.
-Debido a su carga eléctrica, las moléculas polares pueden conducir la electricidad.
Dióxido de azufre (SO2). El oxígeno tiene una electronegatividad de 3,44, mientras que la electronegatividad del azufre es 2,58. Por lo tanto, el oxígeno es más electronegativo que el azufre. Hay dos enlaces S=O, teniendo el O una carga δ- y el S una carga δ+.
Por ser una molécula angular con el S en el vértice, los dos momentos dipolares están orientados en el mismo sentido; y por ello, se suman, haciendo que molécula de SO2 sea polar.
Cloroformo (HCCl3). Hay un enlace C-H y tres enlaces C-Cl.
La electronegatividad de C es 2,55, y la electronegatividad de H es 2,2. Así, el carbono es más electronegativo que el hidrógeno; y por lo tanto, el momento dipolar estará orientado desde el H (δ+) hacia el C (δ-): Cδ--Hδ+.
En el caso de los enlaces C-Cl, el C tiene una electronegatividad de 2,55, mientras que el Cl tiene una electronegatividad de 3,16. El vector dipolo o momento dipolar está orientado desde el C hacia el Cl en los tres enlaces C δ+-Cl δ-.
Al haber una región pobre de electrones, alrededor del átomo de hidrógeno, y una región rica en electrones conformada por los tres átomos de cloro, el CHCl3 se considera una molécula polar.
El fluoruro de hidrógeno tiene un solo enlace H-F. La electronegatividad del H es de 2,22 y la electronegatividad del F es 3,98. Por lo tanto, el flúor termina con la mayor densidad electrónica, y el enlace entre ambos átomos se describe mejor como: Hδ+-Fδ-.
El amoníaco (NH3) tiene tres enlaces N-H. La electronegatividad del N es de 3,06 y la electronegatividad del H es de 2,22. En los tres enlaces, la densidad electrónica está orientada hacia el nitrógeno, siendo aún mayor por la presencia de un par de electrones libres.
La molécula de NH3 es tetraédrica, con el átomo de N ocupando el vértice. Los tres momentos dipolares, correspondientes a los enlaces N-H, están orientados en el mismo sentido. En ellos, δ- está localizado en el N, y δ+ en el H. Así, los enlaces son: Nδ--Hδ+.
Estos momentos dipolares, la asimetría de la molécula, y el par libre de electrones sobre el nitrógeno, hacen del amoníaco una molécula altamente polar.
Cuando las moléculas son muy grandes, deja de ser certero clasificarlas como apolares o polares en sí mismas. Esto se debe a que puede haber partes de su estructura con características tanto apolares (hidrofóbicas), como polares (hidrofílicas).
A este tipo de compuestos se les conoce como anfífilos o anfipáticos. Debido a que la parte apolar se puede considerar pobre en electrones respecto a la parte polar, hay una polaridad presente en la estructura, y se consideran los compuestos anfifílicos como compuestos polares.
Puede esperarse de manera general que una macromolécula con heteroátomos tenga momentos dipolares, y con ello, polaridad química.
Se entiende por heteroátomos aquellos que son diferentes de los que componen el esqueleto de la estructura. Por ejemplo, el esqueleto carbonado es biológicamente el más importante de todos, y al átomo con quien forma enlace el carbono (además del hidrógeno), se le llama heteroátomo.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Prof. Krishnan. (2007). Polar and nonpolar compounds. St. Louis Community College. Recuperado de: users.stlcc.edu
- Murmson, Serm. (14 de marzo de 2018). How to Explain Polarity. Sciencing. Recuperado de: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (05 de diciembre de 2018). Polar Bond Definition and Examples (Polar Covalent Bond). Recuperado de: thoughtco.com
- Wikipedia. (2019). Chemical polarity. Recuperado de: en.wikipedia.org
- Quimitube. (2012). Enlace covalente: polaridad de enlace y polaridad molecular. Recuperado de: quimitube.com
