Ciclooxigenasa: tipos, reacción, inhibidores
Las ciclooxigenasas (COXs), también conocidas como prostaglandina H sintasas o prostaglandina endoperóxido sintasas, son enzimas ácido graso oxigenasas que pertenecen a la superfamilia mieloperoxidasa y que se encuentran en todos los animales vertebrados.
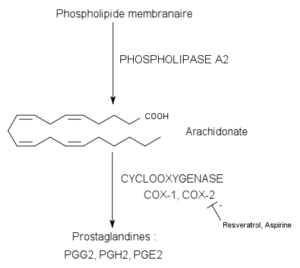
Las ciclooxigenasas son enzimas bifuncionales, pues tienen dos actividades catalíticas distintas: una actividad ciclooxigenasa y otra peroxidasa, que les permiten catalizar la bis-oxigenación y la reducción del ácido araquidónico para formar prostaglandina.
No se han encontrado en plantas, en insectos o en organismos unicelulares, pero en las células de los vertebrados estas enzimas se localizan principalmente en la membrana del retículo endoplásmico, habiendo reportes de su presencia en la envuelta nuclear, cuerpos lipídicos, mitocondrias, estructuras filamentosas, vesículas, etc.
Las primeras detecciones de los productos sintetizados por las ciclooxigenasas fueron realizadas en fluidos seminales, por lo que inicialmente se pensó que se trataba de sustancias producidas en la próstata, razón por la cual se denominaron “prostaglandinas”.
Hoy en día se sabe que las prostaglandinas son sintetizadas en todos los tejidos de los animales vertebrados e incluso en organismos que no poseen glándulas prostáticas, y que los diferentes isómeros de estas moléculas tienen diversas funciones en distintos procesos fisiológicos y patológicos como fiebre, sensibilidad al dolor o algesia, inflamación, trombosis, mitogénesis, vasodilatación y vasoconstricción, ovulación. función renal, etc.
Índice del artículo
Se ha reportado la existencia de dos tipos de ciclooxigenasas entre los animales vertebrados. La primera en ser descubierta y purificada se conoce como COX-1 o simplemente COX, y fue purificada por primera vez en 1976 a partir de las vesículas seminales de ovejas y vacas.
La segunda ciclooxigenasa descubierta entre los eucariotas fue COX-2, en 1991. Hasta la fecha se ha comprobado que todos los animales vertebrados, incluyendo los peces cartilaginosos, los peces óseos, las aves y los mamíferos, poseen dos genes que codifican para las enzimas COX.
Uno de ellos, COX-1, codifica para la ciclooxigenasa 1, que es constitutiva, mientras que el gen COX-2 codifica para la ciclooxigenasa inducible 2.
Las enzimas COX-1 y COX-2 son bastante parecidas, lo que se entiende del 60-65% de similitud entre sus secuencias aminoacídicas.
Los genes COX-1 ortólogos (genes en distintas especies que tienen el mismo origen) en todas las especies de animales vertebrados producen proteínas COX-1 que comparten hasta el 95% de la identidad de sus secuencias aminoacídicas, cosa que también es cierta para los ortólogos de COX-2, cuyos productos comparten entre el 70 y el 90% de identidad.
Los cnidarios y las ascidias también poseen dos genes COX, pero estos son distintos a los de los demás animales, por lo que algunos autores hipotetizan que estos genes pudieron haber surgido en eventos de duplicación independientes a partir del mismo ancestro común.
COX-1
El gen COX-1 pesa aproximadamente 22 kb y se expresa constitutivamente para codificar la proteína COX-1, que tiene más o menos 600 residuos aminoacídicos antes de ser procesada, pues tiene un péptido señal hidrofóbico después de cuya remoción rinde una proteína de aproximadamente 576 aminoácidos.
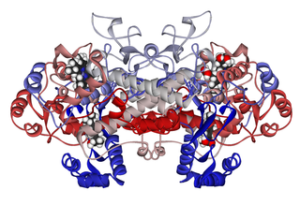
Esta proteína se encuentra principalmente en el retículo endoplásmico y su estructura general es en forma de homodímero, es decir, dos cadenas polipeptídicas idénticas que se asocian para conformar la proteína activa.
COX-2
El gen COX-2, por otra parte, pesa cerca de 8 kb y su expresión es inducida por citoquinas, factores de crecimiento y otras sustancias. Este codifica para la enzima COX-2 que tiene, incluyendo el péptido señal, 604 residuos aminoacídicos y 581 después del procesamiento.
Esta enzima también es homodimérica y se encuentra entre el retículo endoplásmico y la envuelta nuclear.
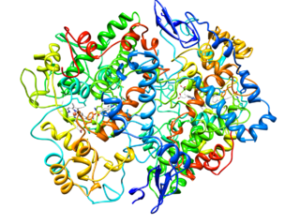
A partir del análisis de sus estructuras se ha determinado que las enzimas COX-1 y COX-2 poseen en su extremo N-terminal y en el sitio adyacente al péptido señal, un “módulo” único de factor de crecimiento epidérmico (EGF, del inglés Epidermal Growth Factor).
En este módulo se encuentran unos enlaces o puentes disulfuro sumamente conservados, que funcionan como “dominio de dimerización” entre los dos polipéptidos de cada enzima homodimérica.
Las proteínas también poseen unas hélices anfipáticas que les facilitan el anclaje a una de las capas de la membrana. Además, el dominio catalítico de ambas tiene dos sitios activos, uno con actividad ciclooxigenasa y otro con actividad peroxidasa.
Ambas enzimas son proteínas sumamente conservadas, encontrándose entre diferentes especies diferencias poco significativas respecto a los mecanismos de dimerización y unión a la membrana, así como también de algunas características de sus dominios catalíticos.
Las proteínas COX tienen, adicionalmente, sitios de glicosilación que son esenciales para su funcionamiento y que están absolutamente conservados.
Las enzimas ciclooxigenasas 1 y 2 se encargan de catalizar los dos primeros pasos de la biosíntesis de prostaglandinas, los cuales comienzan con la conversión del ácido araquidónico en precursores de las prostaglandinas conocidos como hidroperoxi-endoperóxido PGG2.
Para que estas enzimas puedan ejercer sus funciones, deben ser primero activadas a través de un proceso dependiente de su actividad peroxidasa. En otras palabras, su actividad principal depende de la reducción de un sustrato peróxido (mediada por el sitio activo peroxidasa) para que ocurra la oxidación del hierro asociado al grupo hemo que le sirve como cofactor.
La oxidación del grupo hemo provoca la formación de un radical tirosil en el sitio activo ciclooxigenasa, lo que activa la enzima y promueve la iniciación de la reacción ciclooxigenasa. Esta reacción de activación puede ocurrir una sola vez, pues el radical tirosil es regenerado durante la última reacción de la ruta.
Las ciclooxigenasas están implicadas en la síntesis de las prostaglandinas, que son hormonas con funciones en la protección de la mucosa intestinal, en la agregación de las plaquetas y en la regulación de la función renal, además de participar en los procesos de inflamación, dolor y fiebre.
En vista de que estas enzimas son claves para la producción de dichas hormonas, especialmente de aquellas que tienen que ver con los procesos inflamatorios, numerosos estudios farmacológicos se han enfocado en la inhibición de las ciclooxigenasas.
Así, se ha demostrado que el mecanismo de acción de muchas drogas anti-inflamatorias no esteroideas tiene que ver con la acetilación irreversible o reversible (inhibitoria) del sitio activo ciclooxigenasa en estas enzimas.
Entre estas drogas se encuentran piroxicam, ibuprofeno, aspirina, flurbiprofeno, diclofenac, naproxeno y otras.
- Botting, R. M. (2006). Inhibitors of cyclooxygenases: mechanisms, selectivity and uses. Journal of physiology and pharmacology, 57, 113.
- Chandrasekharan, N. V., & Simmons, D. L. (2004). The cyclooxygenases. Genome biology, 5(9), 241.
- Fitzpatrick, F. A. (2004). Cyclooxygenase enzymes: regulation and function. Current pharmaceutical design, 10(6), 577-588.
- Kundu, N., Smyth, M. J., Samsel, L., & Fulton, A. M. (2002). Cyclooxygenase inhibitors block cell growth, increase ceramide and inhibit cell cycle. Breast cancer research and treatment, 76(1), 57-64.
- Rouzer, C. A., & Marnett, L. J. (2009). Cyclooxygenases: structural and functional insights. Journal of lipid research, 50(Supplement), S29-S34.
- Vane, J. R., Bakhle, Y. S., & Botting, R. M. (1998). CYCLOOXYGENASES 1 AND 2. Annual review of pharmacology and toxicology, 38(1), 97-120.
