Silicio: historia, propiedades, estructura, obtención, usos
El silicio es un elemento no metálico y al mismo tiempo metaloide que viene representado por el símbolo químico Si. Se trata de un semiconductor, el cual forma parte esencial de las computadoras, calculadoras, teléfonos celulares, celdas solares, diodos, etc.; prácticamente es el componente principal que ha permitido el asentamiento de la Era Digital.
El silicio ha estado presente desde siempre en el cuarzo y silicatos, ambos minerales componiendo alrededor del 28% en masa de toda la corteza terrestre. Es pues, el segundo elemento más abundante en la superficie de la Tierra, y la vastedad de los desiertos y playas ofrecen una perspectiva de cuán abundante es.

El silicio pertenece al grupo 14 de la tabla periódica, el mismo que del carbono, situado por debajo de este. Es por eso que se considera a este elemento como un metaloide tetravalente; tiene cuatro electrones de valencia y en teoría puede perderlos todos para formar el catión Si4+.
Una propiedad que comparte con el carbón es su capacidad de concatenarse; esto es, sus átomos se enlazan covalentemente para definir cadenas moleculares. Asimismo, el silicio puede formar sus propios “hidrocarburos”, llamados silanos.
Los compuestos predominantes del silicio en la naturaleza son los famosos silicatos. En su forma pura puede presentarse como un sólido monocristalino, policristalino o amorfo. Es un sólido relativamente inerte, por lo que no representa riesgos considerables.
Índice del artículo
- 1 Historia
- 2 Propiedades físicas y químicas
- 2.1 Apariencia física
- 2.2 Masa molar
- 2.3 Número atómico (Z)
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Densidad
- 2.7 Calor de fusión
- 2.8 Calor de vaporización
- 2.9 Capacidad calorífica molar
- 2.10 Electronegatividad
- 2.11 Energías de ionización
- 2.12 Radio atómico
- 2.13 Conductividad térmica
- 2.14 Resistividad eléctrica
- 2.15 Dureza de Mohs
- 2.16 Concatenación
- 2.17 Números de oxidación
- 2.18 Reactividad
- 3 Estructura y configuración electrónica
- 4 Dónde se encuentra y obtención
- 5 Isótopos
- 6 Riesgos
- 7 Usos
- 8 Referencias
El silicio es quizás uno de los elementos que más influencia ha tenido en la historia de la humanidad.
Este elemento es protagonista de la Edad de Piedra, y también de la Era Digital. Sus orígenes se remontan cuando antaño las civilizaciones trabajaban con el cuarzo y elaboraban sus propios vidrios; y actualmente, es el componente principal de las computadoras, portátiles y teléfonos inteligentes.
Prácticamente el silicio ha sido la piedra de dos eras claramente definidas en nuestra historia.
Al ser tan abundante la sílice, nombre nacido de la roca pedernal, debía contener un elemento sumamente rico en la corteza terrestre; esta fue la acertada sospecha de Antoine Lavoisier, quien en 1787 fracasó en sus intentos por reducirlo a partir de su óxido.
Tiempo después, en 1808 Humphry Davy realizó sus propios intentos y le asignó al elemento su primer nombre: ‘silicium’, que traducido vendría a ser como ‘metal de pedernal’. Es decir, el silicio para entonces era considerado un metal debido a su falta de caracterización.
Luego, en 1811 los químicos franceses Joseph L. Gay-Lussac y Louis Jacques Thénard lograron preparar silicio amorfo por vez primera. Para ello hicieron reaccionar el tetrafluoruro de silicio con potasio metálico. Sin embargo, no purificaron ni caracterizaron el producto obtenido, por lo que no concluyeron que se trataba del nuevo elemento silicium.
No fue sino en 1823 cuando el químico sueco Jacob Berzelius obtuvo un silicio amorfo con la suficiente pureza para reconocerlo como el silicio; nombre dado en 1817 por el químico escocés Thomas Thomson al considerarlo un elemento no metálico. Berzelius llevó a cabo la reacción entre el fluorosilicato de potasio y potasio fundido para producir este silicio.
El silicio cristalino se preparó por vez primera en 1854 por el químico francés Henry Deville. Para conseguirlo, Deville realizó una electrólisis de una mezcla de cloruros de aluminio y sodio, obteniendo así cristales de silicio cubiertos por una capa de siliciuro de aluminio, la cual eliminó (al parecer) lavándolos con agua.

El silicio en su forma pura o elemental consiste de un sólido grisáceo o negro azulado (imagen superior), que si bien no es un metal, presenta caras brillantes como si realmente lo fuera.
Es un sólido duro pero quebradizo, que exhibe además una superficie escamosa si está formado por policristales. Por otro lado, el silicio amorfo luce como un sólido pulverizado de color marrón oscuro. Gracias a esto, resulta fácil identificar y diferenciar un tipo de silicio (cristalino o policristalino) de otro (amorfo).
28.085 g/mol
14 (14Si)
1414 ºC
3265 ºC
-A temperatura ambiente: 2,33 g/mL
-Justo en el punto de fusión: 2,57 g/mL
Nótese que el silicio líquido es más denso que el silicio sólido; lo que quiere decir que sus cristales flotarán sobre una fase líquida del mismo, tal como sucede con el sistema hielo-agua. La explicación se debe a que el espacio interatómico entre los átomos Si en su cristal es mayor (menos denso), que el correspondiente en el líquido (más denso).
50,21 kJ/mol
383 kJ/mol
19,789 J/(mol·K)
1,90 en la escala de Pauling
-Primera: 786,5 kJ/mol
-Segunda: 1577,1 kJ/mol
-Tercera: 3231,6 kJ/mol
111 pm (medido en sus respectivos cristales diamantados)
149 W/(m·K)
2.3·103 Ω·m a 20 ºC
6,5
Los átomos de silicio tienen la capacidad de formar enlaces simples Si-Si, los cuales terminan definiendo una cadena (Si-Si-Si…).
Esta propiedad también la manifiestan el carbono y el azufre; sin embargo, las hibridaciones sp3 del silicio son más deficientes en comparación a la de los otros dos elementos y, además, sus orbitales 3p son más difusos, por lo que el traslape de los orbitales sp3 resultantes es más débil.
Las energías promedio de los enlaces covalentes Si-Si y C-C son 226 kJ/mol y 356 kJ/mol, respectivamente. Por lo tanto, los enlaces Si-Si son más débiles. Debido a esto, el silicio no es la piedra angular de la vida (ni tampoco el azufre). De hecho, la cadena o esqueleto más largo que puede formar el silicio suele ser de cuatro miembros (Si4).
El silicio puede tener cualquiera de los siguientes números de oxidación, asumiendo en cada uno de ellos la existencia de los iones con sus respectivas cargas: -4 (Si4-), -3 (Si3-), -2 (Si2-), -1 (Si–), +1 (Si+), +2 (Si2+), +3 (Si3+) y +4 (Si4+). De todos ellos, el -4 y +4 son los más importantes.
Por ejemplo, el -4 se asume en los siliciuros (Mg2Si o Mg22+Si4-); mientras que el +4 corresponde al de la sílice (SiO2 o Si4+O22-).
El silicio es completamente insoluble en agua, así como en ácidos o bases fuertes. Sin embargo, se disuelve en una mezcla concentrada de ácidos nítrico y fluorhídrico (HNO3-HF). Igualmente, se disuelve en una solución alcalina caliente, ocurriendo la siguiente reacción química:
Si(s) + 2NaOH(ac) + H2O(l) => Na2SiO3(ac) + 2H2(g)
La sal metasilicato de sodio, Na2SiO3, se forma también cuando el silicio se disuelve en carbonato de sodio fundido:
Si(s) + Na2CO3(l) => Na2SiO3(l) + C(s)
A temperatura ambiente no reacciona en lo absoluto con el oxígeno, ni siquiera a 900 ºC, cuando comienza a formarse una capa vítrea protectora de SiO2; y luego, a 1400 ºC, el silicio reacciona con el nitrógeno del aire para formar una mezcla de nitruros, SiN and Si3N4.
El silicio también reacciona a altas temperaturas con los metales para formar siliciuros metálicos:
2Mg(s) + Si(s) => Mg2Si(s)
2Cu(s) + Si(s) => Cu2Si(s)
A temperatura ambiente reacciona explosiva y directamente con los halógenos (no hay capa SiO2 que lo proteja de esto). Por ejemplo, se tiene la reacción de formación del SiF4:
Si(s) + 2F2(g) => SiF4(g)
Y aunque el silicio es insoluble en el agua, al rojo vivo reacciona con una corriente de vapor:
Si(s) + H2O(g) => SiO2(s) + 2H2(g)
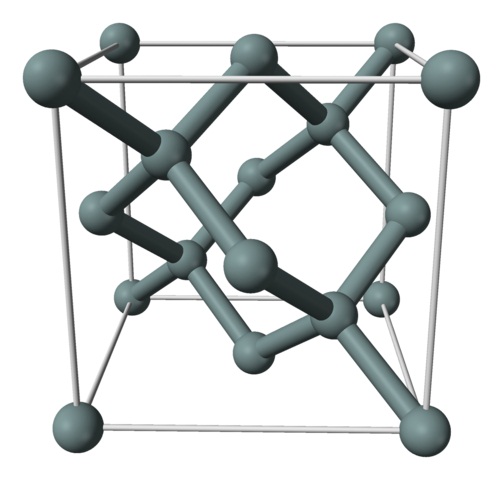
En la imagen superior se muestra la estructura cúbica centrada en las caras (fcc), la misma que la del diamante, para el cristal de silicio. Las esferas grisáceas corresponden a los átomos Si, que como se aprecia, están enlazados covalentemente unos con otros; además, tienen a su vez entornos tetraédricos que se reproducen a lo largo del cristal.
El cristal de silicio es fcc porque se observa un átomo Si ubicado en cada una de las caras del cubo (6×1/2). Asimismo, hay ocho átomos Si en los vértices del cubo (8×1/8), y cuatro ubicados en el interior del mismo (los que muestran un tetraedro bien definido a su alrededor, 4×1).
Dicho lo anterior, cada celda unitaria tiene un total de ocho átomos de silicio (3 + 1 + 4, números señalados en el párrafo de arriba); característica que ayuda a explicar su alta dureza y rigidez, pues el silicio puro se trata de un cristal covalente al igual que el diamante.
Este carácter covalente se debe a que, como el carbono, el silicio cuenta con cuatro electrones de valencia de acuerdo a su configuración electrónica:
[Ne] 3s2 3p2
Para enlazarse, los orbitales 3s y 2p puros son inútiles. Es por eso que el átomo crea cuatro orbitales híbridos sp3, con los cuales puede formar cuatro enlaces covalentes Si-Si y, de esta manera, completar el octeto de valencia para los dos átomos de silicio.
El cristal de silicio se visualiza entonces como una red covalente y tridimensional compuesta por tetraedros interconectados.
Sin embargo, dicha red no es perfecta, ya que presenta defectos y límites de granos, los cuales separan y definen un cristal de otro; y cuando tales cristales son muy pequeños y numerosos, se habla de un sólido policristalino, identificado por su brillo heterogéneo (parecido a un mosaico o superficie escamosa plateados).
Los enlaces Si-Si, con sus electrones bien localizados, en principio discrepan con lo que se espera de un metal: un mar de electrones “mojando” sus átomos; al menos, esto es así a temperatura ambiente.
Cuando la temperatura se incrementa, no obstante, el silicio empieza a conducir la electricidad y, por lo tanto, se comporta como un metal; es decir, se trata de un elemento metaloide semiconductor.
Los tetraedros de silicio no siempre adoptan un patrón estructural, sino que pueden disponerse de manera desordenada; e inclusive, con átomos de silicio cuyas hibridaciones parecieran no ser sp3 sino sp2, lo cual contribuye a incrementar todavía más el grado de desorden. Por lo tanto, se habla de un silicio amorfo y no cristalino.
En el silicio amorfo se presenta vacancias electrónicas, donde algunos de sus átomos tienen un orbital con un electrón desapareado. Gracias a esto, su sólido puede hidrogenarse, dando lugar a la formación de silicio amorfo hidrogenado; es decir, tiene enlaces Si-H, con los cuales se completan los tetraedros en posiciones desordenadas y arbitrarias.
Se concluye entonces este apartado diciendo que el silicio puede presentarse en tres tipos de sólidos (sin mencionar su grado de pureza): cristalino, policristalino y amorfo.
Cada uno de ellos tiene su propio método o proceso de producción, así como sus aplicaciones y disyuntivas al momento de decidir cuál de los tres utilizar, conociendo sus ventajas y desventajas.

El silicio es el séptimo elemento más abundante del Universo, y el segundo en la corteza terrestre, enriqueciendo asimismo el manto de la Tierra con su vasta familia de minerales. Este elemento se asocia extraordinariamente bien con el oxígeno, formando toda una amplia gama de óxidos; entre ellos, la sílice, SO2, y los silicatos (de composición química diversa).
La sílice puede apreciarse a simple vista en los desiertos y playas, pues la arena se compone principalmente de SiO2. A su vez, este óxido puede manifestarse en unos cuantos polimorfos, siendo los más comunes: cuarzo, amatista, ágata, cristobalita, trípoli, coesita, stishovita y tridimita. Además, puede hallarse en sólidos amorfos como los ópalos y tierras diatomeas.
Los silicatos, por su parte, son aún más ricos estructural y químicamente. Entre algunos de los minerales silicatos pueden mencionarse: asbestos (blanco, café y azulado), feldespato, arcillas, micas, olivinos, aluminosilicatos, zeolitas, anfíboles y piroxenos.
Prácticamente, todas las rocas están compuestas de silicio y oxígeno, con sus enlaces estables Si-O, y sus sílices y silicatos mezclados con óxidos metálicos y especies inorgánicas.
El problema que representa la obtención del silicio es romper dicho enlace Si-O, para lo cual se necesita de hornos especiales y una buena estrategia de reducción. La materia prima para este proceso es la sílice en forma de cuarzo, el cual se muele previamente hasta que quede como un polvo fino.
A partir de esta sílice molida, puede prepararse bien sea el silicio amorfo o el policristalino.
Silicio amorfo
A pequeña escala, realizado en un laboratorio y con las medidas pertinentes, la sílice se mezcla con polvo de magnesio en un crisol y se le incinera en ausencia de aire. La siguiente reacción toma lugar entonces:
SiO2(s) + Mg(s) => 2MgO(s) + Si(s)
El magnesio y su óxido se eliminan con una solución diluida de ácido clorhídrico. Luego, el sólido remanente se trata con ácido fluorhídrico, para que termine de reaccionar el SiO2 en exceso; de lo contrario, el exceso de magnesio favorece la formación de su respectivo siliciuro, Mg2Si, compuesto indeseable para el proceso.
El SiO2 se transforma en el gas volátil SiF4, el cual se recupera para otras síntesis químicas. Finalmente, la masa de silicio amorfo se pone a secar bajo una corriente de hidrógeno gaseoso.
Otro método similar para obtener silicio amorfo consiste en utilizar el mismo SiF4 producido anteriormente, o el SiCl4 (adquirido previamente). Los vapores de estos halogenuros de silicio se hacen pasar encima de sodio líquido en una atmósfera inerte, para que así pueda darse la reducción del gas sin la presencia del oxígeno:
SiCl4(g) + 4Na(l) => Si(s) + 4NaCl(l)
Curiosamente, con el silicio amorfo se fabrican paneles solares de alto rendimiento energético.
Silicio cristalino
Partiendo nuevamente de la sílice o cuarzo pulverizados, se llevan a un horno de arco eléctrico, donde reacciona con coque. De esta manera, el agente reductor ya no es un metal sino un material carbonáceo de alta pureza:
SiO2(s) + 2C(s) => Si(s) + 2CO(g)
En la reacción se produce también carburo de silicio, SiC, el cual se neutraliza con un exceso de SiO2 (otra vez el cuarzo está en exceso):
2SiC(s) + SiO2(s) => 3Si(s) + 2CO(g)
Otro método para preparar silicio cristalino es empleando aluminio como agente reductor:
3SiO2(s) + 4Al(l) => 3Si(s) + 2Al2O3(s)
Y partiendo de la sal hexafluorurosilicato de potasio, K2[SiF6], también se hace reaccionar con aluminio o potasio metálicos para originar el mismo producto:
K2[SiF6] (l) + 4Al(l) => 3Si(s) + 6KF(l) + 4AlF3(g)
Inmediatamente el silicio se disuelve en el aluminio fundido, y cuando el sistema se pone a enfriar, el primero cristaliza y se separa del segundo; es decir, se forman los cristales de silicio, los cuales lucen colores grisáceos.
Silicio policristalino
A diferencia de las demás síntesis o producciones, para obtener el silicio policristalino se empieza con una fase gaseosa de silano, SiH4. Este gas se somete a una pirolisis por encima de los 500 ºC, de tal manera que ocurre una descomposición térmica y así, de sus vapores iniciales, terminan depositándose policristales de silicio sobre una superficie semiconductora.
La siguiente ecuación química ejemplifica la reacción que toma lugar:
SiH4(g) => Si(s) + H2(g)
Obviamente, no debe haber nada de oxígeno en la cámara, pues reaccionaría con el SiH4:
SiH4(g) + 2O2(g) => SiO2(s) + 2H2O(g)
Y es tal la espontaneidad de la reacción de combustión, que ocurre rápidamente a temperatura ambiente ante la mínima exposición del silano con el aire.
Otra ruta sintética para producir este tipo de silicio parte del silicio cristalino como materia prima. Lo hacen reaccionar con cloruro de hidrógeno a una temperatura alrededor de los 300 ºC, para que se forme así el triclorosilano:
Si(s) + 3HCl(g) => SiCl3H(g) + H2(g)
Y el SiCl3H reacciona a 1100 ºC para volver a regenerar el silicio, pero ahora policristalino:
4SiCl3H(g) => Si(s) + 3SiCl4(g) + 2H2(g)
Basta con ver las ecuaciones para darse una idea del trabajo y rigurosos parámetros de producción que deben ser considerados.
El silicio se presenta natural y principalmente como el isótopo 28Si, con una abundancia de 92,23%.
Además de este, existen otros dos isótopos que son estables y que por tanto no sufren decaimiento radiactivo: el 29Si, con una abundancia de 4,67%; y 30Si, con una abundancia de 3,10%. Siendo tan abundante el 28Si, no es de extrañar que el peso atómico del silicio sea 28,084 u.
El silicio también puede hallarse en varios radioisótopos, entre los cuales destacan el 31Si (t1/2=2,62 horas) y 32Si (t1/2=153 años). Los demás (22Si – 44Si) tienen t1/2 muy cortos o breves (menores a centésimas de segundos).
El silicio puro es una sustancia relativamente inerte, por lo que no suele acumularse en ningún órgano o tejido siempre y cuando la exposición al mismo sea baja. En forma de polvo puede provocar irritaciones en los ojos, causándoles lagrimeos o enrojecimientos, a la vez que tocarlo puede causar molestias en la piel, picazón y descamación.
Cuando la exposición es muy alta, el silicio puede lastimar los pulmones; pero sin efectos posteriores, a menos que la cantidad sea la suficiente para provocar asfixia. No obstante, no ocurre así con el cuarzo, el cual sí está asociado con el cáncer pulmonar y enfermedades como la bronquitis y enfisemas.
Asimismo, el silicio puro es muy raro en la naturaleza, y sus compuestos, tan abundantes en la corteza terrestre, no representan ningún riesgo para el medio ambiente.
Ahora bien, respecto a los organosilicios estos sí pudieran ser tóxicos; pero al haber muchos de ellos depende de cuál se esté considerando, al igual que de otros factores (reactividad, pH, mecanismo de acción, etc.).
Los minerales de silicio integran la “piedra” con la que se construyen los edificios, casas, o monumentos. Por ejemplo, los cementos, concretos, estucos y ladrillos refractarios, consisten de mezclas sólidas basadas en silicatos. Desde este enfoque, puede uno figurarse la utilidad que tiene este elemento en las ciudades y en la arquitectura.
A partir de la sílice pueden fabricarse cristales utilizados en dispositivos ópticos, ya sean como aislantes, celdas para las muestras espectrofotómetros, cristales piezoeléctricos o meros lentes.
Asimismo, cuando el material se prepara con múltiples aditivos, termina transformándose en un sólido amorfo, bien conocido como vidrio; y montañas de arena suelen ser la fuente de la sílice o cuarzo necesarios para su producción. Por otro lado, con los silicatos se fabrican materiales cerámicos y porcelanas.
Entrelazando las ideas, el silicio también está presente en la artesanía y ornamentaciones.
Los átomos de silicio pueden cohesionar y ser miscibles con una matriz metálica, por lo que es un aditivo para numerosas aleaciones o metales; por ejemplo, acero, para fabricar núcleos magnéticos; bronces, para la fabricación de cables telefónicos; y aluminio, en la producción de la aleación aluminio-silicio destinada para piezas automotrices livianas.
Por lo tanto, no solo puede hallarse en la “piedra” de los edificios, sino además en los metales de sus columnas.

La sílice, en forma de gel o amorfa, permite fabricar sólidos que actúan como desecantes al atrapar las moléculas de agua que entran al recipiente y mantener su interior seco.

Capas de silicio de diferentes grosores y colores forman parte de chips de computadora, al igual que con su sólido (cristalino o amorfo), se han diseñado circuitos integrados y celdas solares.
Al ser un semiconductor, se le incorpora átomos con menos (Al, B, Ga) o más electrones (P, As, Sb) para transformarlo en semiconductores de tipo p o n, respectivamente. Con las uniones de dos silicios, uno n y el otro p, se fabrican diodos de emisores de luz.
El famoso pegamento de silicona consiste de un polímero orgánico sustentado por la estabilidad de las cadenas de los enlaces Si-O-Si… Si estas cadenas son muy largas, cortas o entrecruzadas, las propiedades del polímero de silicón cambian, así como sus aplicaciones finales.
Entre sus usos, enlistados a continuación, pueden mencionarse los siguientes:
-Pegamentos o adhesivos, no solamente para unir papeles, sino bloques de construcción, cauchos, paneles de vidrio, rocas, etc.
-Lubricantes en sistemas de frenado hidráulicos
-Refuerza las pinturas y mejora el brillo e intensidad de sus colores, al mismo tiempo que le permite resistir los cambios de temperatura sin que se agriete o carcome
-Se utilizan como sprays repelentes al agua, con lo cual se mantiene secas algunas superficies u objetos
-Otorgan a productos de higiene personal (pastas dentales, champúes, geles, cremas de afeitar, etc.) la sensación de ser sedosos
-Sus recubrimientos protegen del calor y la humedad los componentes electrónicos de dispositivos delicados, como los microprocesadores
-Con polímeros de silicón se han elaborado varias de las pelotas de goma que rebotan apenas se las dejan caer al piso.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Silicon. Recuperado de: en.wikipedia.org
- MicroChemicals. (s.f.). Crystallography of silicon. Recuperado de: microchemicals.com
- Lenntech B.V. (2019). Periodic table: silicon. Recuperado de: lenntech.com
- Marques Miguel. (s.f.). Silicon Ocurrence. Recuperado de: nautilus.fis.uc.pt
- More Hemant. (05 de noviembre de 2017). Silicon. Recuperado de: hemantmore.org.in
- Pilgaard Michael. (22 de agosto de 2018). Silicon: Occurrence, isolation & synthesis. Recuperado de: pilgaardelements.com
- Dr. Doug Stewart. (2019). Silicon Element Facts. Chemicool. Recuperado de: chemicool.com
- Christiana Honsberg and Stuart Bowden. (2019). A collection of resources for the photovoltaic educator. PVeducation. Recuperado de: pveducation.org
- American Chemistry Council, Inc. (2019). Silicones in Everyday Life. Recuperado de: sehsc.americanchemistry.com
