Deuterio: qué es, estructura, propiedades, usos
¿Qué es el deuterio?
El deuterio es una de las especies isotópicas del hidrógeno, el cual se representa como D o 2H. Además, se le ha dado el nombre de hidrógeno pesado, debido a que su masa es dos veces la del protón. Un isótopo es una especie que proviene de un mismo elemento químico, pero cuyo número másico es distinto a este.
Esta distinción se debe a la diferencia en el número de neutrones que posee. El deuterio se considera un isótopo estable y se puede encontrar en compuestos formados por hidrógeno de origen natural, aunque en una proporción bastante pequeña (menor al 0,02 %).
Dadas sus propiedades, muy similares a las del hidrógeno ordinario, puede sustituir al hidrógeno en la totalidad de las reacciones en las cuales este participa, convirtiéndose en sustancias equivalentes.
Por esta y otras razones, este isótopo tiene una gran cantidad de aplicaciones en distintas áreas de la ciencia, convirtiéndose en uno de los más importantes.
Estructura del deuterio
La estructura del deuterio está constituida principalmente por un núcleo que posee un protón y un neutrón, con un peso atómico o masa de aproximadamente 2,014 g.
Del mismo modo, este isótopo debe su descubrimiento a Harold C. Urey, un químico oriundo de los Estados Unidos, y sus colaboradores Ferdinand Brickwedde y George Murphy, en el año 1931.
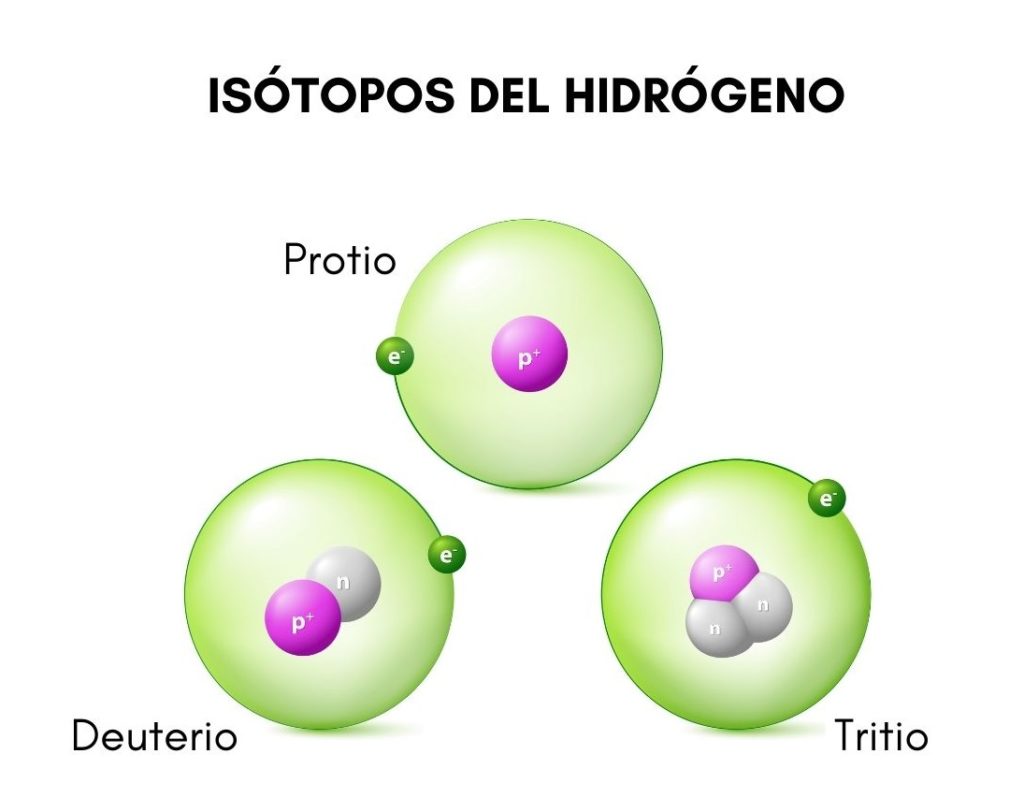
En la imagen superior se puede observar la comparación entre las estructuras de los isótopos del hidrógeno, el cual existe en forma de protio (su isótopo más abundante), deuterio y tritio, ordenados de izquierda a derecha.
La preparación del deuterio en su estado puro fue llevada a cabo exitosamente por primera vez en el año 1933, pero desde la década de 1950 se ha empleado una sustancia en fase sólida y que posee demostrada estabilidad, denominada deuteruro de litio (LiD), para sustituir al deuterio y al tritio en una gran cantidad de reacciones químicas.
En este sentido, se ha estudiado la abundancia de este isótopo y se ha podido observar que la proporción del mismo en el agua puede variar ligeramente, dependiendo de la fuente de donde se tome la muestra.
Además, mediante estudios de espectroscopía se ha determinado la existencia de este isótopo en otros planetas de esta galaxia.
Algunos datos sobre el deuterio
La diferencia fundamental entre los isótopos del hidrógeno (los cuales son los únicos que han sido nombrados de distintas maneras) radica en su estructura, debido a que la cantidad de protones y neutrones de una especie le confieren sus propiedades químicas.
Por otro lado, el deuterio existente en el interior de los cuerpos estelares es eliminado con mayor velocidad de la que es originado.
Además, se considera que otros fenómenos de la naturaleza forman únicamente una cantidad ínfima del mismo, por lo que su producción continúa generando interés en la actualidad.
De manera similar, una serie de investigaciones ha revelado que la gran mayoría de los átomos que se han formado de esta especie se originaron en el Big Bang; esta es la razón por la cual se advierte su presencia en planetas de gran tamaño como Júpiter.
Como la manera más común de conseguir esta especie en la naturaleza es cuando se encuentra combinada con hidrógeno en forma de protio, aún sigue despertando el interés de la comunidad científica la relación que se establece entre la proporción de ambas especies en diferentes ámbitos de las ciencias, tales como la astronomía o la climatología.
Propiedades del deuterio
– Es un isótopo carente de características radiactivas; es decir, es bastante estable en la naturaleza.
– Se puede utilizar para sustituir al átomo de hidrógeno en las reacciones químicas.
– Esta especie manifiesta un comportamiento distinto al hidrógeno ordinario en las reacciones de naturaleza bioquímica.
– Cuando se sustituyen los dos átomos de hidrógeno en el agua, se obtiene D2O, adquiriendo el nombre de agua pesada.
– El hidrógeno presente en el océano que se encuentra en forma de deuterio existe en una proporción de 0,016 % en relación al protio.
– En las estrellas, este isótopo posee una tendencia a fusionarse de manera rápida para dar origen al helio.
– El D2O constituye una especie tóxica, aunque sus propiedades químicas son muy similares a las del H2
– Cuando se someten átomos de deuterio al proceso de fusión nuclear a elevadas temperaturas, se obtiene el desprendimiento de grandes cantidades de energía.
– Las propiedades físicas como el punto de ebullición, la densidad, el calor de vaporización, el punto triple, entre otras, poseen magnitudes mayores en las moléculas de deuterio (D2) que en las de hidrógeno (H2).
– La forma más común en la que se encuentra es enlazado a un átomo de hidrógeno, originando deuteruro de hidrógeno (HD).
Usos/aplicaciones
Debido a sus propiedades, el deuterio es empleado en una gran variedad de aplicaciones en las que está involucrado el hidrógeno. Algunos de estos usos se describen a continuación:
– En el campo de la bioquímica se emplea en el marcaje isotópico, el cual consiste en “marcar” una muestra con el isótopo seleccionado para rastrearla a través de su paso por un sistema determinado.
– En reactores nucleares que llevan a cabo reacciones de fusión se utiliza para disminuir la velocidad con la que se mueven los neutrones sin la elevada absorción de estos que presenta el hidrógeno ordinario.
– En el área de la resonancia magnética nuclear (RMN) son utilizados los solventes con base en el deuterio para obtener muestras de este tipo de espectroscopía sin la presencia de interferencias que se producen al utilizar solventes hidrogenados.
– En el campo de la biología se estudian las macromoléculas a través de técnicas de dispersión de neutrones, donde se utilizan las muestras provistas de deuterio para disminuir significativamente el ruido en estas propiedades de contraste.
– En el área de farmacología se utiliza la sustitución de hidrógeno por deuterio por el efecto isotópico cinético que se genera y permite que estos fármacos posean una vida media más prolongada.
