Hidrofílico: usos del término, características, ejemplos
Un hidrofílico o hidrófilo es un segmento molecular o un compuesto que se caracterizan por tener una fuerte afinidad por el agua y los solventes polares. Etimológicamente significa ‘amantes del agua’, lo que implica que un hidrófilo será capaz de disolverse o interaccionar eficientemente con las moléculas del agua.
Por lo tanto, las sustancias hidrofílicas tienden a ser solubles o miscibles con el agua. Sin embargo, la hidrofilicidad, es decir, su afinidad por el agua y otros solventes polares, no solo se vincula con la solubilidad en sí misma, sino también con el grado de mojabilidad que existe entre el agua y las superficies de estas sustancias o materiales.
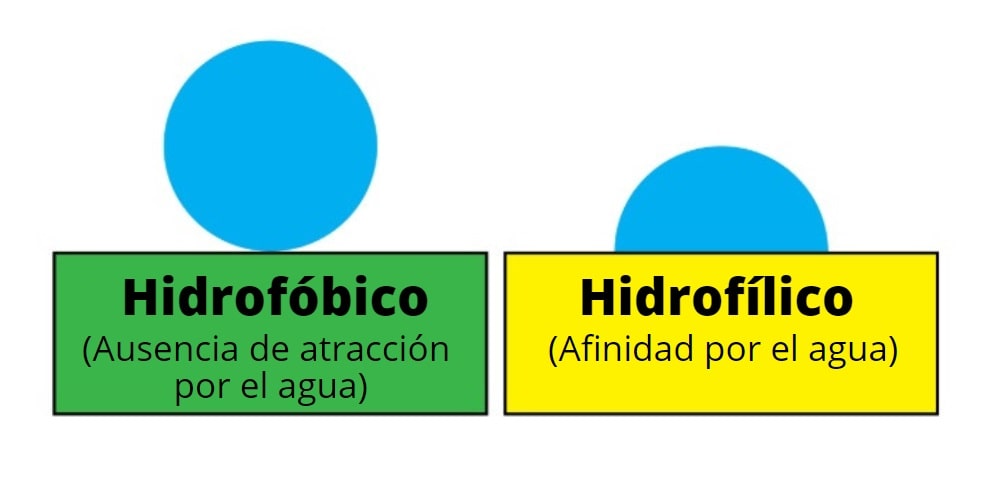
Es así que las superficies hidrofílicas son más fáciles de mojar o humedecer que las hidrofóbicas, aquellas que odian al agua o la repelen. Las primeras aplanan las gotas de agua en hileras, mientras que las segundas las tornan redondas y prominentes. La visualización de dichas gotas es uno de los principales factores para diferenciar un material hidrofílico de uno hidrofóbico.
El concepto de hidrofilicidad es esencial para la comprensión de la química de superficie, de las disoluciones, las interfases, y el carácter anfifílico de sustancias tales como las proteínas y los ácidos grasos.
Índice del artículo
- 1 Usos del término hidrofílico o hidrófilo
- 2 Características de las sustancias hidrofílicas
- 3 Superficies hidrofílicas
- 4 Ejemplos de sustancias hidrofílicas
- 5 Referencias
Los términos ‘hidrofílico’ e ‘hidrófilo’ se designan tanto a moléculas como a porciones estructurales de las mismas. No obstante, ‘hidrófilo’ se utiliza principalmente para referirse a cualquier molécula o compuesto que tenga mucha afinidad por el agua.
Se habla pues de una molécula hidrofílica o de un hidrófilo, si su afinidad por el agua es muy alta de acuerdo a ciertas consideraciones. Por ejemplo, la sacarosa es un compuesto hidrofílico, lo que es igual a decir que es un hidrófilo, ya que sus cristales se disuelven fácilmente en cualquier volumen de agua.
La molécula en cuestión puede presentar segmentos o partes estructurales hidrofílicas, las cuales pueden bien estar constituidas por un esqueleto carbonado, o simplemente por un grupo polar. Cuando se trata de un grupo, decimos por lo general que es un grupo hidrofílico, el cual contribuye a la hidrofilicidad de la molécula o de la superficie a la que pertenece.
Usualmente, ‘hidrofílico’ se usa con mayor frecuencia que ‘hidrófilo’, ya que este último suele reservarse más que todo para las moléculas o compuestos que sean completamente hidrofílicos; es decir, que no posean regiones hidrofóbicas en sus estructuras moleculares. Esto es especialmente cierto cuando se describen macromoléculas o sólidos poliméricos.
Las sustancias hidrofílicas son compuestos covalentes, lo que significa que sus unidades constan de moléculas y no de redes iónicas. Por lo tanto, aunque las sales tienden a ser muy solubles en agua, aún más que muchos hidrófilos, no se les suele designar como tales al no consistir de moléculas.
Por otro lado, no todas las sales son solubles en agua, como el cloruro de plata, AgCl, razón por la cual no se les puede clasificar de hidrófilos.
Para que una molécula sea hidrofílica debe tener cierta polaridad. Esto solo es posible si posee en su estructura grupos polares tales como -OH, -SH, -NH2, -COOH, etc., de manera que contribuyan a su momento dipolar permanente y, por ende, a su hidrofilicidad.
Los hidrófilos se reconocen por encima de otros compuestos debido a su capacidad de formar puentes de hidrógeno con las moléculas del agua. Nótese que los grupos polares mencionados arriba tienen la capacidad de donar hidrógenos o aceptarlos para formar tales puentes, los cuales son un tipo especial de interacciones dipolo-dipolo.
Los hidrófilos pueden ser sustancias gaseosas, líquidas o sólidas, siendo las más comunes estas dos últimas.
Los líquidos hidrofílicos son miscibles con el agua, por lo que al mezclarse no se verán dos fases.
Mientras, los sólidos hidrofílicos se disuelven en el agua o la absorben con mucha facilidad; pero además, algunos tienen la capacidad de mojarse o humedecerse sin disolverse en lo absoluto, ya que aunque su superficie sea hidrofílica, no lo es del todo su masa interior. Este es el caso de muchos materiales poliméricos, tales como las siliconas químicamente modificadas.
Las superficies hidrofílicas son objeto de estudios de la química de superficie. No son solubles en agua, pero pueden humedecerse y aplanar las gotas de agua que se depositan sobre ella. Esto se debe a que poseen grupos hidrofílicos externos que interactúan eficientemente con las moléculas del agua.
La gota de agua forma con la superficie hidrofílica un ángulo de contacto menor a 90º, lo que es igual a decir que presentará una forma aplanada, poco esférica o redonda.
Tal es así, que las gotas terminan expandiéndose y corriendo como hileras de líquido. Por ejemplo, esta propiedad se utiliza para impedir que la niebla empañe la superficie, ya que apenas la toca el agua condensa y resbala hacia abajo.
Nuestra piel es hidrofílica, ya que sobre ella las gotas tienden a aplanarse y resbalar; excepto cuando está embardunada de aceite o una crema. Entonces las gotas de agua serán redondas y definidas, debido a que la superficie se ha vuelto temporalmente hidrofóbica.
El amoníaco, NH3, es un hidrófilo porque su molécula puede formar varios puentes de hidrógeno con el agua. Esto hace que tanto en estado gaseoso como líquido sea muy soluble en el agua.
El ácido oxálico, H2C2O4, es un hidrófilo, ya que su sólido es muy soluble en el agua debido a los puentes de hidrógeno que puede formar con sus dos grupos –COOH.
El metanol, CH3OH, es un hidrófilo gracias a su grupo OH.
Los alcoholes por lo general son sustancias hidrofílicas, siempre y cuando su esqueleto carbonado no sea muy grande. Por ejemplo, el 1-propanol y 2-propanol son miscibles con el agua, pero no ocurre así con el 1-butanol, cuya miscibilidad se hace menor a causa de su cadena carbonada de mayor longitud.
El almidón es un ejemplo de un polímero hidrofílico, ya que sus unidades de glucosa disponen de múltiples grupos OH con los cuales forma puentes de hidrógeno con las moléculas del agua.
La madera es hidrofílica y, aunque no se disuelva en el agua, sí se humedece rápidamente si no se le trata con revestimientos hidrofóbicos.
Las proteínas disponen de grupos polares muy afines al agua. Por lo tanto, sus interacciones con las moléculas del agua son eficientes. Esto no implica, sin embargo, que todas las proteínas sean solubles en agua, ya que sus estructuras (terciarias y cuaternarias) juegan un papel fundamental en dicho proceso de disolución.
El vidrio es un material hidrofílico porque, si bien no consta de moléculas sino de redes SiO2 tridimensionales, sus átomos de oxígeno pueden aceptar puentes de hidrógeno del agua. Esta es la razón por la que los vasos de vidrio sudan en ambientes húmedos.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Hydrophile. Recuperado de: en.wikipedia.org
- David L. Chandler. (16 de julio de 2013). Explained: Hydrophobic and hydrophilic. Recuperado de: news.mit.edu
- Gelest. (2020). Hydrophilic Materials. Recuperado de: gelest.com
- Ahmad Darem et al. (05 de septiembre de 2018). Hydrophilic and hydrophobic materials and their applications. Taylor & Francis Online. doi.org/10.1080/15567036.2018.1511642
