Modelos atómicos: qué son, tipos, características, autores
¿Qué son los modelos atómicos?
Los modelos atómicos son representaciones gráficas de la estructura y funcionamiento de un átomo. Han existido numerosos modelos a lo largo de la historia.
Esto se debe a que la idea del átomo como bloque fundamental del que está hecha la materia, nació hace miles de años, en la antigua Grecia. En esa época el átomo era solo un producto de la especulación filosófica.
A medida que se hicieron nuevos descubrimientos científicos, se crearon nuevos modelos para incorporar los conocimientos adquiridos. Y así ha ocurrido siglo tras siglo hasta la actualidad, cuando la tecnología ha permitido observar los átomos a través de microscopios y determinar el modelo correcto.
¿Qué son los átomos?
Los átomos son estructuras submicroscópicas de las que está formada toda la materia que percibimos y con la que interactuamos cada día, desde nuestro propio cuerpo, los alimentos que ingerimos, la ropa que vestimos, hasta los grandes rascacielos y aeronaves.
Asimismo, el Sol, la Luna, los planetas, las estrellas y las galaxias están formadas de átomos.
Estos son tan pequeños que no se pueden ver con los microscopios comunes. Se requieren otros de mayor potencia, llamados ultramicroscopios. Sin embargo, los átomos no son las unidades más pequeñas de la naturaleza.
Los átomos están formados a su vez por partículas más pequeñas aún: los protones, los neutrones y los electrones.
Los protones tienen carga eléctrica positiva, mientras que los neutrones no poseen carga eléctrica alguna. Estos dos tipos de partículas forman el núcleo del átomo.
Girando alrededor del núcleo como planetas alrededor del Sol están los electrones, que poseen carga eléctrica negativa.
Modelo atómico de Demócrito

Demócrito de Abdera fue un filósofo griego que vivió en entre los años 460 y 370 antes de la era actual. Afirmó que toda la materia estaba formada por diminutas partículas a las que llamó átomos, que en griego quiere decir indivisible.
De acuerdo con Demócrito, el átomo es la porción más pequeña en que se puede dividir la materia. Hay un número infinito de ellos, que son indestructibles, increados, eternos y absolutamente compactos, sin poros. Existen de varios tipos, que se diferencian por la forma, la magnitud, la posición y la manera en que están dispuestos.
La teoría de Demócrito fue rechazada por Aristóteles y luego totalmente olvidada hasta el surgimiento de la ciencia moderna.
Modelo atómico de Dalton

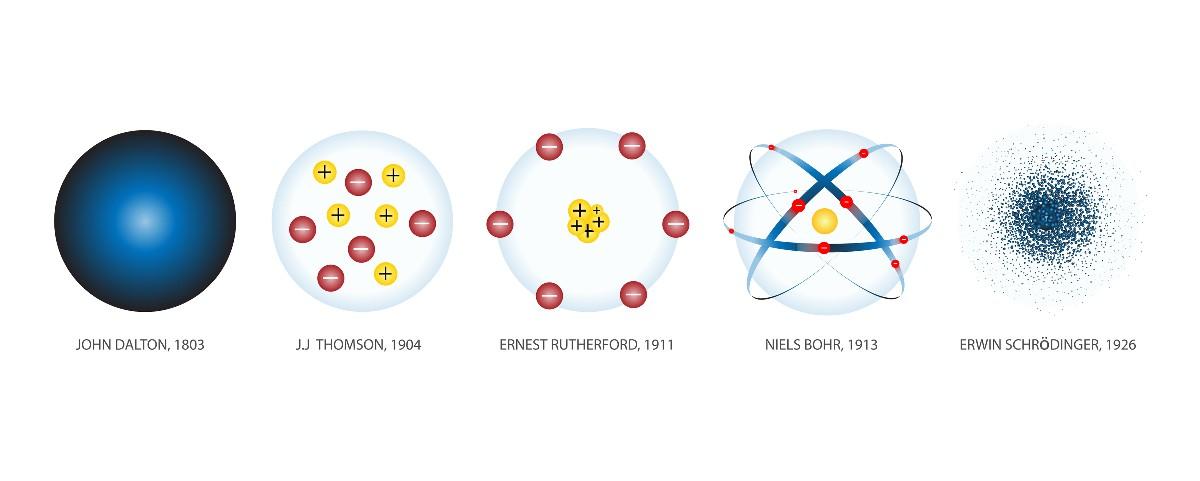
John Dalton (1766-1844) fue un meteorólogo inglés interesado en investigar las leyes que rigen el comportamiento de los gases. Fruto de su trabajo en ese campo fue el primer modelo atómico de la ciencia moderna, que hizo en 1803.
Puesto que aún no se había descubierto la existencia de los protones y los electrones, Dalton afirmó, al igual que Demócrito, que el átomo es la porción más pequeña en que puede ser dividida la materia y, por tanto, en sí mismo, es indivisible.
Según Dalton, los átomos son sólidos y tienen forma esférica, como una bola de béisbol. Dalton ilustró su teoría tallando en madera, junto con sus ayudantes, decenas de esferas que representaban átomos de distintos elementos químicos.
Este modelo estuvo vigente hasta el descubrimiento del electrón.
Modelo atómico de Thomson

Al físico inglés Joseph John Thomson (1865-1940) le correspondió hacer uno de los más importantes descubrimientos de la ciencia moderna: el del electrón.
Fue en 1897, en el laboratorio Cavendish de la Universidad de Cambridge, en Inglaterra, donde una placa aún conmemora el gran descubrimiento.
Thompson y sus asistentes proyectaron un haz de rayos catódicos sobre un campo eléctrico. Al entrar en contacto con el campo, los rayos se desviaron formando amplios ángulos. Esto confirmaba que los rayos catódicos tenían una carga eléctrica negativa. A esas partículas cargadas negativamente las llamó electrones.
Thomson asumió que los electrones estaban incrustados en los átomos. Su modelo atómico data de 1904.
El pudin de pasas
En el modelo atómico de Thompson el átomo es una esfera sólida con carga positiva (protones) sobre la cual los neutrones (carga negativa) están distribuidos al azar, como pasas echadas sobre pudin. Por eso a este modelo se le conoció como el “pudin de pasas”.
Según Thompson, el átomo posee un radio de 0,00000001 centímetros y su carga es neutra, puesto que protones y electrones tienen la misma carga, pero de opuesto signo.
El modelo de Thompson no presenta neutrones.
Modelo atómico de Rutherford

Ernest Rutherford (1871-1937), físico neozelandés, fue uno de los alumnos más destacados de Thomson.
En 1911, y con base en el entonces reciente descubrimiento de la radioactividad, Rutherford llevó a cabo el siguiente experimento: dispararon partículas radiactivas alfa de gran velocidad y energía contra una lámina de oro.
Si el modelo atómico de Thompson era correcto, las partículas alfa pasarían a través de la lámina sin desviarse o con una desviación insignificante. Sin embargo, cuando calcularon el ángulo de desviación de las partículas descubrieron que era amplio, y que algunas incluso rebotaban contra la lámina de oro.
Con este resultado Rutherford comprendió que el átomo debía tener un núcleo muy pequeño y altamente condensado. Este núcleo estaba cargado positivamente.
Un diminuto sistema solar
El modelo atómico de Rutherford es como un sistema solar en miniatura. En el centro, en el lugar que correspondería al Sol, está el núcleo con sus protones cargados positivamente. Alrededor de este, orbitando como planetas, se encuentran los electrones distribuidos al azar.
Rutherford también estableció que la masa del átomo es equivalente a la suma de las masas de electrones y protones.
Modelo atómico de Bohr

Aunque el modelo de Rutherford constituía un avance innegable respecto a los modelos anteriores, tenía defectos importantes. Por ejemplo, si los electrones efectivamente orbitaran con libertad alrededor del núcleo acabarían perdiendo energía y colapsarían sobre el núcleo. Pero esto, obviamente, no sucedía.
Fue el físico danés Niels Bohr (1885-1962), alumno de Rutherford en la Universidad de Manchester (Inglaterra), quien propondría en 1913 un nuevo modelo atómico que solucionaba los problemas que planteaba el de su viejo profesor.
Órbitas circulares
En el modelo atómico de Bohr los electrones no orbitan libremente alrededor del núcleo, sino que lo hacen en órbitas circulares estables, separados entre sí por una cierta distancia, de manera similar a como están dispuestos los planetas del sistema solar. Cada órbita recibe el nombre de capa o nivel energético.
Basándose en las investigaciones de Max Planck y Albert Einstein, determinó que cada electrón en su órbita tiene una cantidad determinada de energía.
Mientras orbitan de manera estable alrededor del núcleo, se dice que los electrones se encuentran en estado estacionario. En cambio, cuando un electrón “salta” a una órbita de menor energía, se produce un fotón.
Sin embargo, el modelo de Bohr no tuvo éxito para explicar el funcionamiento de átomos con más de un electrón.
Modelo atómico de Sommerfeld
Arnold Sommerfeld (1868-1951) fue un físico alemán que dedicó su trabajo a ampliar el modelo atómico de Bohr. Este modelo extendido fue presentado en 1916.
Con base en la teoría de la relatividad de Einstein, Sommerfeld descubrió que algunos electrones orbitaban alrededor del núcleo a velocidades cercanas a la de la luz (300.000 kilómetros por segundo).
Hizo también las siguientes modificaciones al modelo de Bohr:
- Los electrones se mueven alrededor del núcleo en órbitas circulares y elípticas. Bohr solo reconoció las órbitas circulares.
- Dentro de un mismo nivel energético existen subniveles con energías ligeramente diferentes.
Modelo mecánico cuántico (Broglie, Heisenberg y Schrödinger)
Este es el modelo atómico más preciso que se conoce y es el aceptado en la actualidad,con algunas adiciones posteriores. Fue desarrollado por tres científicos: el alemán Werner Heisenberg (1901-1976), el austríaco Erwin Schrödinger (1887-1961) y el francés Louis de Broglie (1892-1987).
Este modelo descarta la idea de los electrones que orbitan el núcleo. En su lugar, tenemos nubes electrónicas, que son espacios alrededor del núcleo en los cuales es posible hallar un electrón. Este se comporta como una onda estacionaria.
La probabilidad de encontrarlo se calcula con una ecuación establecida por Schrödinger.
Se trata del modelo mecánico cuántico del átomo que partía de la ecuación de Schrödinger. Con esta ecuación se podía conocer la probabilidad de encontrar un electrón en un determinado punto de un átomo.
En este modelo cada electrón se mueve en una dirección específica, la cual viene determinada por cuatro números cuánticos, que son: número cuántico principal, número cuántico secundario, número cuántico magnético y número cuántico spin.
No existen dos electrones que posean idénticos números cuánticos, como afirma el principio de exclusión descubierto por el físico Wolfgang Pauli.
Referencias
- (2010). Átomo. Britannica Enciclopedia Moderna.
- (s. f.). Modelo atómico de Demócrito, el atomismo filosófico. Tomado de energia-nuclear.net.
- (s. f.). Modelo atómico de Sommerfeld, ampliación al modelo de Bohr. Tomado de energia-nuclear.net.
- Bertsch, G. F.; Trefil, James y McGrayne, Sharon Bertsch (2021). Atom. Encyclopedia Britannica. Tomado de britannica.com.
- Duignan, B. (2021). Democritus. Encyclopedia Britannica. Tomado de britannica.com.
- New World Encyclopedia contributors. (2021). Atom. Tomado de newworldencyclopedia.org.
- Zita, Ana. (s. f.). Modelos atómicos. Tomado de todamateria.com.
