Permanganato de potasio (KMnO4): estructura, propiedades, usos, síntesis

¿Qué es el permanganato de potasio?
El permanganato de potasio (KMnO4) es un compuesto inorgánico formado por manganeso —metal de transición del grupo 7 (VIIB)—, oxígeno y potasio. Es un sólido vítreo color morado oscuro. Sus soluciones acuosas también son moradas oscuras; estas soluciones se van tornando menos violeta a medida que se diluyen en cantidades mayores de agua.
Comercialmente se consigue en presentaciones de tabletas, cristales y polvo. Es conocido con los nombres de cristales de Condy o minerales camaleón. El término “camaleón” alude a la capacidad del mineral: si cambia de color en contacto de soda caústica y materia orgánica, se produce, por ejemplo, el azúcar.
El KMnO4 comienza entonces a sufrir reducciones (ganar electrones) en una sucesión de colores en el siguiente orden: morado > azul > verde > amarillo > incoloro (con precipitado pardo de MnO2). Esta reacción demuestra una propiedad importante del permanganato de potasio: es un agente oxidante muy fuerte.
Fórmula
Su fórmula química es KMnO4; es decir, que por cada catión K+ hay un anión MnO4– interaccionando con este
Estructura química del permanganato de potasio
En la imagen superior se representa la estructura cristalina del KMnO4, la cual es de tipo ortorrómbica. Las esferas púrpuras corresponden a los cationes K+, mientras que el tetraedro formado por las cuatro esferas rojas y la esfera azulada corresponde al anión MnO4–.
¿Por qué el anión posee una geometría tetraédrica? Su estructura de Lewis responde a esta pregunta. Las líneas punteadas significan que los dobles enlaces están resonando entre el Mn y el O. Para poder adoptar esta estructura, el centro metálico debe tener una hibridación sp3.
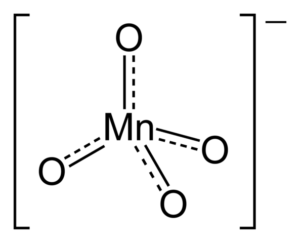
Como el manganeso carece de pares de electrones sin compartir, los enlaces Mn-O no son empujados hacia un mismo plano. Asimismo, la carga negativa se distribuye entre los cuatro átomos de oxígeno, siendo responsables de la orientación de los cationes K+ dentro de los arreglos cristalinos.
Usos del KMnO4
Medicina y veterinaria
Debido a su acción bactericida, se usa en numerosas enfermedades y condiciones que producen lesiones en la piel, tales como: infecciones de los pies con hongos, impétigo, heridas superficiales, dermatitis y úlceras tropicales.
Por su acción dañina, el permanganato de potasio deber ser usado a bajas concentraciones (1:10000), lo que limita la eficacia de su acción.
También se utiliza en el tratamiento de las parasitosis de los peces en los acuarios que producen infecciones de las agallas y úlceras de la piel.
Tratamiento del agua
Es un regenerante químico usado para remover del agua el hierro, el magnesio y el sulfuro de hidrógeno (de un olor desagradable), pudiéndose usar para purificar las aguas residuales.
El hierro y el magnesio precipitan en la forma de sus óxidos insolubles en agua. Además, ayuda a remover la herrumbre presente en las tuberías.
Preservación de las frutas
El permanganato de potasio remueve por oxidación el etileno generado en el banano durante su almacenaje, permitiendo que pueda permanecer por más de 4 semanas sin madurar, inclusive a temperatura ambiente.
En África lo usan para remojar los vegetales, con la finalidad de neutralizar y eliminar cualquier agente bacteriano presente.
Acción sobre el fuego
Se usa el permanganato de potasio para limitar la extensión de incendios. Basándose en la capacidad del permanganato de iniciar el fuego, se utiliza para crear contrafuegos en los incendios forestales.
Titulante redox
En química analítica se emplean sus soluciones acuosas estandarizadas como titulante oxidante en determinaciones redox.
Reactivo en síntesis orgánicas
Sirve para convertir alquenos en dioles; esto es, dos grupos OH son adicionados al enlace doble C=C. La siguiente ecuación química:

Asimismo, en solución de ácido sulfúrico con ácido crómico (H2CrO4) se emplea para la oxidación de los alcoholes primarios (R-OH) a ácidos carboxílicos (R-COOH o RCO2H).
Su poder oxidante es lo suficiente fuerte para oxidar los grupos alquílicos primarios o secundarios de los compuestos aromáticos “carboxilándolos”; es decir, transformando la cadena lateral R (por ejemplo, un CH3) en un grupo COOH.
Usos históricos
Formaba parte de los polvos usados como flash en fotografía o para iniciar la reacción de termita.
Fue usado en la Segunda Guerra Mundial para el camuflaje de los caballos blancos durante el día. Para esto utilizaban el dióxido de manganeso (MnO2), que es de color marrón; de este modo pasaban desapercibidos.
Síntesis del KMnO4
El mineral pirolusita contiene dióxido de manganeso (MnO2) y carbonato de potasio (CaCO3).
En 1659 el químico Johann R. Glauber fundió el mineral y lo disolvió en agua, observando la aparición de una coloración verde en la solución, que posteriormente cambió a color violeta y por último a rojo. Este último color correspondió a la generación del permanganato de potasio.
A mediados del siglo XIX Henry Condy buscaba un producto antiséptico y trató inicialmente la pirolusita con NaOH y posteriormente con KOH, produciendo los llamados cristales de Condy; es decir, el permanganato de potasio.
El permanganato de potasio es producido industrialmente a partir de dióxido de manganeso presente en el mineral pirolusita. El MnO2 presente en el mineral reacciona con el hidróxido de potasio y es calentado posteriormente en presencia de oxígeno.
2 MnO2 + 4 KOH + O2 => 2 K2MnO4 + 2 H2O
El manganato de potasio (K2MnO4) es convertido en permanganato de potasio por oxidación electrolítica en un medio alcalino.
2 K2MnO4 + 2 H2O => 2 KMnO4 + 2 KOH + H2
En otra reacción para producir el permanganato de potasio, se hace reaccionar el manganato de potasio con CO2, acelerando el proceso de desproporción:
3 K2MnO4 + 2 CO2 => 2 KMnO4 + MnO2 + K2CO3
Debido a la generación del MnO2 (dióxido de manganeso) el proceso es desfavorable, debiéndose generar KOH a partir del K2CO3.
Propiedades del KMnO4
Es un sólido cristalino de color púrpura que funde a 240 ºC, el cual tiene una densidad de 2,7 g/mL, y un peso molecular de 158 g/mol aproximadamente.
Es poco soluble en agua (6,4 g/100 ml a 20 ºC), lo cual indica que las moléculas de agua no solvatan en gran medida a los iones MnO4–, debido a que quizás sus geometrías tetraédricas requieran de mucha agua para su disolución. Del mismo modo, también puede disolverse en alcohol metílico, acetona, ácido acético y piridina.
Descomposición
Se descompone a 240 ºC, liberando oxígeno:
2KMnO4 => K2MnO4 + MnO2 + O2
Puede experimentar descomposición por la acción del alcohol y otros solventes orgánicos, así como por la acción de ácidos fuertes y agentes reductores.
Poder oxidante
En esta sal el manganeso exhibe su mayor estado de oxidación (+7), o lo que es igual, a la máxima cantidad de electrones que puede perder de manera iónica. A su vez, la configuración electrónica del manganeso es 3d54s2; por lo tanto, en el permanganato de potasio toda la capa de valencia del átomo de manganeso está “vacía”.
Entonces, el átomo de manganeso presenta la tendencia natural de ganar electrones; es decir, a reducirse a otros estados de oxidación en medios alcalinos o ácidos. Esta es la explicación de por qué el KMnO4 es un poderoso agente oxidante.
Referencias
- F.Albert Cotton y Geoffrey Wilkinson, FRS. (1980). Química Inorgánica Avanzada. Editorial Limusa, México, 2da edición, pág 437-452.
- Robin Wasserman. Medical Uses for Potassium Permanganate. Recuperado de livestrong.com
- Clark D. The 3 Ultimate Uses Of Potassium Permanganate. Recuperado de technology.org
- J.M. Medialdea, C. Arnáiz y E. Díaz. Permanganato de potasio: un potente y versátil oxidante. Dpto. de Ingeniería Química y Ambiental. Escuela Universitaria de Sevilla.
