Electrones internos: qué son, características, ejemplos
¿Qué son los electrones internos?
Siempre que pensamos en un átomo, nos imaginamos un núcleo formado por protones y neutrones, rodeado por los electrones que giran a su alrededor, de manera similar a como los planetas giran en torno al sol.
Pero no todos los electrones son iguales y se pueden distinguir dos clases, dependiendo de qué tan cerca o lejos se encuentren del núcleo atómico.
Algunos se encuentran más lejos del núcleo y se llaman electrones de valencia. Estos son responsables de todas las reacciones químicas que conocemos. Por otro lado, los que están más cercanos al núcleo y están más fuertemente unidos a él, son a los que llamamos electrones internos.
Características de los electrones internos
Son los electrones más estables
Como regla general, mientras más bajo es el nivel de energía de un electrón, este es más estable. Los electrones internos ocupan los orbitales en los niveles más bajos de energía de un átomo, por lo tanto, son también los electrones más estables.
Están más fuertemente unidos al núcleo
El núcleo atrae a los electrones porque ambos tienen cargas opuestas: el núcleo es positivo mientras que los electrones negativos. Esta fuerza aumenta a medida que disminuye la distancia.
Como consecuencia de esto, los electrones internos, que son los que están más cercanos al núcleo, también son los que están más fuertemente unidos al mismo. Por esta misma razón, también son los electrones más difíciles de remover.
No forman parte de los enlaces químicos
Cuando un átomo se acerca a otro, lo primero en tocarse son sus electrones más externos. Por esta razón, solo los electrones de valencia intervienen en las reacciones químicas. Los electrones internos ni participan en los enlaces químicos, ni intervienen en ninguna reacción química.
Son muy apantallantes
Esto quiere decir que los electrones internos se interponen entre los electrones externos y el núcleo, creando una especie de pantalla que reduce la fuerza con la que el núcleo atrae a los electrones de valencia.
Siempre vienen en parejas
En cada orbital solo caben dos electrones con espines opuestos, a los que se les llama electrones apareados (que es otra manera de decir que forman una pareja). Como los orbitales donde se encuentran los electrones internos siempre están completamente llenos, entonces estos electrones siempre están apareados.
¿Cómo sabemos cuántos electrones internos tiene un átomo?
Saber cuántos electrones internos tiene un átomo es muy sencillo. Solo hace falta saber cuántos electrones en total tiene el átomo, y cuántos de esos electrones pertenecen a la capa de valencia. Todos los demás electrones son los electrones internos.
Pero, ¿cómo averiguamos estos números? En las siguientes secciones lo explicamos.
El número total de electrones es igual al número atómico
Como los átomos son neutros (es decir, no tienen carga eléctrica neta), tienen que tener el mismo número de cargas positivas (protones) que cargas negativas (electrones). Como el número atómico indica cuántos protones hay en el núcleo, entonces también indica cuántos electrones tiene alrededor un átomo cuando es neutro.
En el caso de los iones, que a diferencia de los átomos sí tienen carga eléctrica, el número total de electrones se obtiene restando el número atómico menos la carga del ion, con todo y su signo.
Ejemplos
- El átomo de carbono (C) es el elemento número 6 de la tabla periódica (ése es su número atómico). Por lo tanto, el átomo de carbono tiene 6 electrones en total.
- El ion sodio (I) (Na+) tiene una carga positiva de +1, y el número atómico del sodio es 11. Así que el número total de electrones de este ion es: 11 – (+1) = 10 electrones.
- El ion cloruro (Cl–) tiene una carga negativa de -1, y el número atómico del cloro es 17. Así que el número total de electrones de este ion es: 17 – ( – 1) = 17 + 1 = 18 electrones.
El número de electrones de valencia es igual a su grupo en la tabla periódica
Los elementos que pertenecen al grupo 1A (los metales alcalinos) todos tienen 1 electrón de valencia. Los que pertenecen al 2A (alcalinotérreos) tienen 2, los del 3A (grupo del boro, aluminio, galio, etc.) tienen 3 y así sucesivamente. Esto no aplica a los metales de transición.
Al igual que antes, a los iones se les resta su carga al calcular sus electrones de valencia.
Ejemplos
- El oxígeno pertenece al grupo 6A por lo que posee 6 electrones de valencia.
- El ion sulfuro (S2-) también pertenece al grupo 6A, pero tiene una carga de -2, por lo que tiene: 6 – (–2) = 6 + 2 = 8 electrones de valencia.
Ejemplos de diferentes átomos y sus electrones internos
Electrones internos del carbono (C)
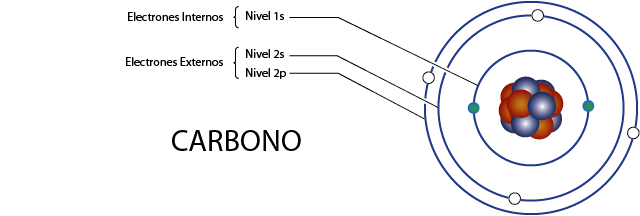
Como vimos hace un momento, el carbono posee 6 electrones en total. Además, pertenece al grupo 4A por lo que tiene 4 electrones de valencia, así que tiene, en total 6 – 4 = 2 electrones internos.
Electrones internos del nitrógeno (N)
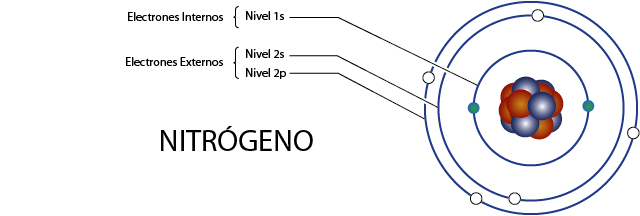
El nitrógeno posee 7 electrones en total. Además, pertenece al grupo 5A por lo que tiene 5 electrones de valencia, así que tiene, en total 7 – 5 = 2 electrones internos.
Electrones internos del argón (Ar)
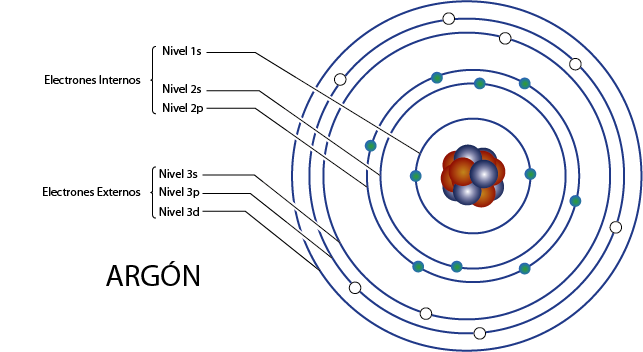
El argón es el elemento 18 por lo que posee 18 electrones en total. Además, pertenece al grupo 8A por lo que tiene 8 electrones de valencia, así que tiene, en total 18 – 8 = 10 electrones internos.
Electrones internos del ion cloruro (Cl–)
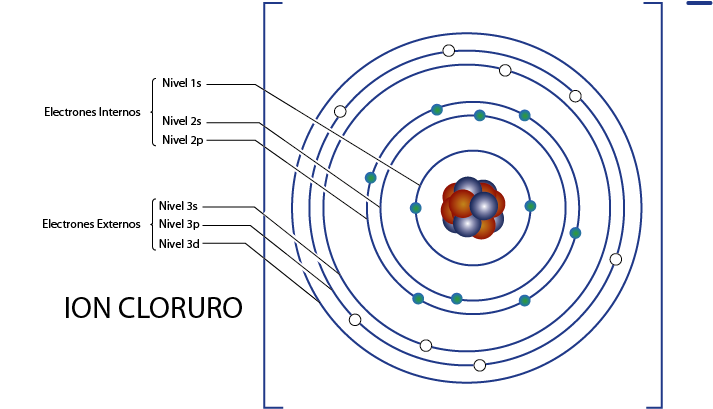
Como vimos hace un momento, el cloruro posee 18 electrones en total. Además, pertenece al grupo 7A y tiene carga -1, por lo que tiene 7 – (– 1) = 8 electrones de valencia. Así que tiene 18 – 8 = 10 electrones internos, al igual que el argón.
Electrones internos del ion calcio +2 (Ca2+)
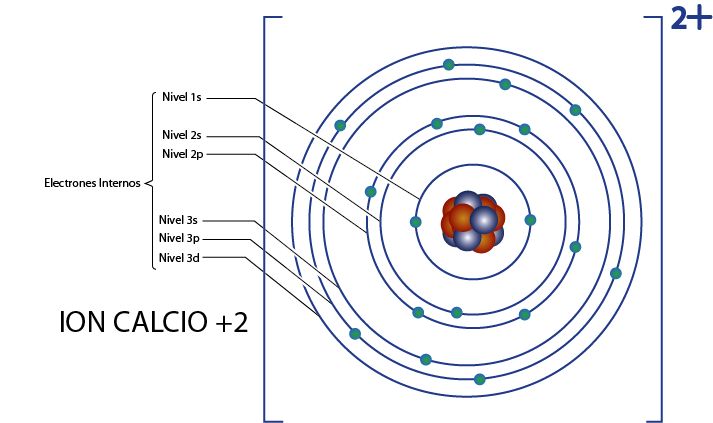
El calcio es el elemento 20, y este ion tiene 2 cargas positivas, así que tiene un total de 20 – 2 = 18 electrones alrededor del núcleo. Este elemento pertenece al grupo 2A y como su carga es +2, entonces no le quedan electrones de valencia (2 – 2 = 0). Por esta razón, todos los 18 electrones que le quedan al calcio son los que originalmente eran los electrones internos.
Hay dos elementos que no tienen electrones internos
Los dos elementos más ligeros de la tabla periódica, que son el hidrógeno (H) y el helio (He), solo tienen 1 y 2 electrones respectivamente. Ambos electrones se encuentran en el único nivel de energía que tienen dichos átomos, que es el nivel 1.
Por esta razón, estos electrones corresponden a los electrones de valencia de estos dos elementos. Como no hay niveles de energía más bajos, entonces tampoco hay electrones internos.
