Isotermas de adsorción: concepto, tipos, ejemplos
Las isotermas de adsorción son representaciones gráficas del comportamiento de una partícula adsorbida, sobre la superficie de un sólido o líquido, cuando se incrementa su concentración. Si las partículas adsorbidas corresponden a las de un gas, entonces se toma en cuenta su presión.
Mediante la observación de esta isoterma puede tenerse una idea de cómo transcurre el proceso de adsorción; y por lo tanto, de cómo son las interacciones partículas-superficie, y de las características de la superficie. Analizando la isoterma se deduce si la superficie es lisa, porosa, o microporosa, así como de posibles condensaciones.

La imagen superior ayuda a clarificar lo anterior comentado. Las partículas adsorbidas (círculos morados) son las llamadas adsorbatos. Mientras que el adsorbente es el que dispone de una superficie sobre la que se adsorberán los adsorbatos. A medida que aumenta su presión o concentración, mayor será el volumen adsorbido sobre el adsorbente.
Esta representación simple corresponde a una adsorción descrita por la isoterma de tipo I. Haciendo uso de las isotermas, se estudian las adsorciones de infinidades de gases o líquidos sobre geles, sólidos o catalizadores.
Índice del artículo
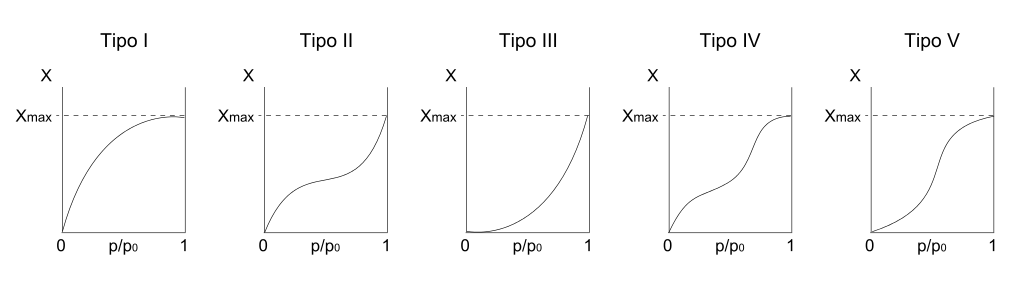
Se muestra arriba cinco de las principales isotermas experimentales utilizadas por S. Brunauer para clasificar las adsorciones de partículas gaseosas sobre sólidos. Cada una describe un proceso de adsorción diferente. Asimismo, cada una posee modelos matemáticos que procuran deducir el comportamiento de sus curvas.
Indistintamente de cuáles sean las unidades o las variables utilizadas en los ejes X (p/po) y Y (X), el eje X señala cuánta presión o concentración de adsorbato “actúa” sobre el sólido; mientras que el eje Y, señala cuánto de ese adsorbato realmente se adsorbió sobre la superficie de dicho sólido o adsorbente.
Así, a medida que nos desplazamos hacia la derecha del eje X, vemos cómo aumenta la cantidad de partículas adsorbidas en función del incremento de sus presiones o concentraciones. Esto conlleva a que se observen un máximo, un decaimiento, un valle, etc., que de algún modo u otro permiten interpretar cómo toma lugar la adsorción.
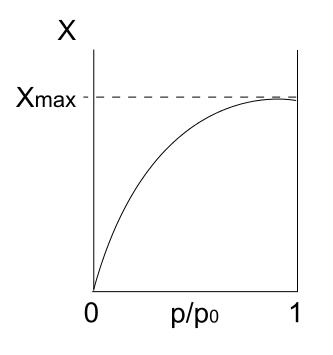
Tenemos arriba la isoterma tipo I, la cual también se conoce como isoterma de Langmuir, dado que su modelo predijo la forma de esta curva. Al verla, de inmediato se interpreta que hay una cantidad máxima (Xmax) de partículas adsorbidas, la cual no variará sin importar cuánto se incrementen las presiones.
Este valor máximo de adsorción puede deberse a varias razones. Una de ellas es que está ocurriendo una quimisorción, lo que significa que las partículas o los adsorbatos se unen fuertemente a la superficie del sólido o adsorbente. Una vez no haya más espacio sobre la superficie para dar cabida a más partículas, no habrá más adsorción.
Se dice pues, que se ha formado una monocapa (como la de los círculos morados de la primera imagen).
Otra razón para justificar la isoterma tipo I, es que ocurre una fisisorción, lo cual significa que las interacciones partículas-superficie son muy débiles (no implican formación de enlaces químicos).
En este caso las partículas terminan entrando a unos microporos, los cuales una vez llenos, la superficie no contará con más sitios para siguientes adsorciones; es decir, tiene poca área externa disponible (como si fuera un enrejado muy fino). Este comportamiento se observa cuando se analizan polvos microporosos.
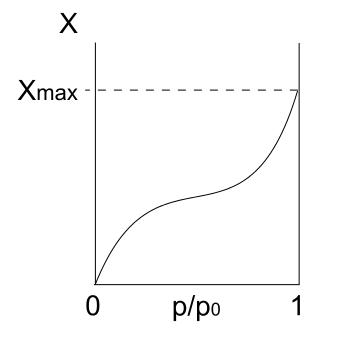
Arriba tenemos la isoterma tipo II, también conocida como isoterma sigmoide. Esta describe procesos de fisisorción tanto para sólidos no porosos como para sólidos macroporosos.
Nótese que al principio se asemeja a la isoterma anterior, lo que significa que las partículas adsorbidas están formando una monocapa sobre la superficie del adsorbente. Una vez esté lista la monocapa, las demás partículas se adsorberán encima de las primeras, dando lugar a multicapas. Es aquí cuando vemos el incremento característico de esta isoterma (a la derecha).
Otra razón por la que se obtiene la isoterma tipo II es porque las partículas sienten mayor afinidad por la superficie que por ellas mismas. Es decir, que la monocapa (partículas-superficie) será más estable y duradera que las multicapas (partículas-partículas) formadas después.
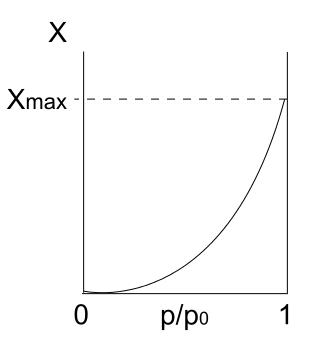
La isoterma tipo III es parecida a la de tipo II en lo que respecta a su interpretación: las multicapas y una fisisorción. Sin embargo, esta vez las interacciones entre las multicapas son más fuertes que las de la monocapa con la superficie del sólido. Por lo tanto, se trata de una adsorción irregular, con montículos de partículas adsorbidas y partes superficiales libres.
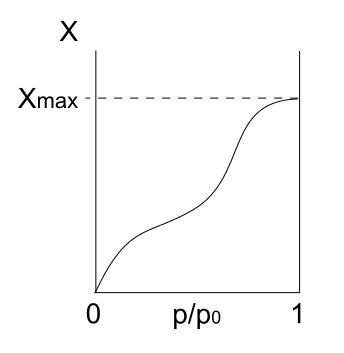
La isoterma de tipo IV describe también procesos de fisisorción y de multicapas, pareciéndose a la isoterma tipo II; pero ahora, en sólidos porosos (y mesoporosos), donde es posible la condensación de las partículas gaseosas en volúmenes pequeños de líquido. Hasta que no esté “tapado” el poro con líquido, la monocapa no estará completa.
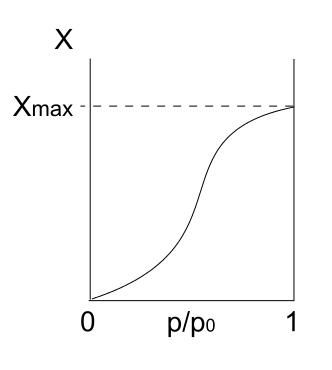
La isoterma de tipo V es similar a la de tipo IV, solamente que esta vez son más propensas las formaciones de multicapas que la respectiva monocapa. Es decir, se parece a la adsorción descrita por la isoterma de tipo III. Aquí la multicapa alcanza un espesor máximo, donde ya no hay sitios para que más partículas se adsorban.
Se mencionarán a continuación algunos ejemplos de sistemas gas-sólido junto al tipo de isotermas que se han obtenido en sus estudios experimentales:
-Amoníaco-carbón (tipo I)
-Nitrógeno-zeolitas (tipo I)
-Hidrógeno-carbón a altas temperaturas (tipo I)
-Oxígeno-negro de carbón (tipo I)
-Nitrógeno-gel de sílice (tipo II)
-Nitrógeno-hierro (tipo II)
-Bromo-gel de sílice (tipo III)
-Vapor de yodo-gel de sílice (tipo III)
-Nitrógeno-polietileno (tipo III)
-Kriptón-negro de carbón (tipo IV)
-Benceno-gel de óxido férrico (tipo IV)
-Vapor de agua-carbón (tipo V)
Nótese que los sólidos mencionados fueron carbón, negro de carbón, hierro metálico, óxido de hierro, zeolitas y gel de sílice. Todos ellos son buenos ejemplos de adsorbentes con variadas aplicaciones industriales.
- Walter J. Moore. (1963). Physical Chemistry. In Thermodynamics and chemical equilibrium. (Fourth ed.). Longmans.
- Ira N. Levine. (2009). Principios de fisicoquímica. Sexta edición, pág 479-540. Mc Graw Hill.
- Glasstone. (1970). Textbook of physical chemistry. Second edition. D. Van Nostrand, Company, Inc.
- Unidad 3. Fenómenos de Superficie. (s.f.). Adsorción. [PDF]. Recuperado de: depa.fquim.unam.mx
- Lowell S., Shields J.E. (1984) Adsorption isotherms. In: Powder Surface Area and Porosity. Springer, Dordrecht.
- Elsevier B.V. (2020). Adsorption Isotherm. ScienceDirect. Recuperado de: sciencedirect.com
- Wikipedia. (2020). Adsorption. Recuperado de: en.wikipedia.org
