Cloruro de mercurio (II): estructura, propiedades, obtención, usos
El cloruro de mercurio (II) es un compuesto inorgánico formado por un átomo del metal mercurio (Hg) y dos átomos del halógeno cloro (Cl). El mercurio se encuentra en su estado de oxidación de +2 y el cloro -1.
Su fórmula química es HgCl2. Es un sólido blanco cristalino ligeramente volátil a temperatura ambiente. Las uniones entre sus átomos son más covalentes que iónicas.
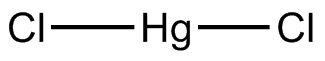
Cuando se disuelve en agua mantiene su estructura molecular. Además es soluble en varios solventes orgánicos. Por acción de la luz tiende a formar mercurio metálico.
En el pasado se empleaba como antiséptico y para tratar ciertas enfermedades infecciosas, tanto en humanos como en animales. También como insecticida para controlar plagas como hormigas y termitas.
Sin embargo, al comprobarse su alta toxicidad la mayoría de estos usos fue abandonada y actualmente se utiliza solo en laboratorios de química o de análisis bioquímicos.
Puede explotar bajo ciertas condiciones. Es un compuesto venenoso, causa daño a humanos, animales y plantas. Nunca debe desecharse al ambiente. Además se sospecha que sea carcinógeno.
Índice del artículo
El cloruro de mercurio está formado por Hg en estado de oxidación II y cloro con valencia -1. En este haluro los enlaces entre los átomos presentan un carácter covalente muy marcado.
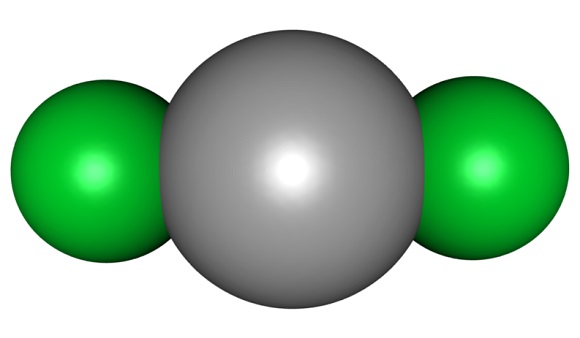
Esto significa que en el cristal el compuesto mantiene su estructura molecular Cl-Hg-Cl donde la distancia Hg-Cl es similar a cuando se encuentra en estado gaseoso, mientras que en el cristal la distancia con los átomos de cloro de otras moléculas es mucho mayor.

En estado gaseoso es claramente molecular e igualmente en solución acuosa.
- Cloruro de mercurio (II)
- Cloruro mercúrico
- Bicloruro de mercurio
- Dicloromercurio
Sólido cristalino blanco, cristales rómbicos.

271,5 g/mol
280 ºC
A 300 °C sublima, es decir, pasa directamente de sólido a gas.
5,6 g/cm3
Poco soluble en agua: 7,31 g/100 mL a 25°C. Soluble en alcohol: 33 g/ 100 mL a 25 °C. Soluble en acetato de etilo. Poco soluble en éter: 4 g/100 mL. Algo soluble en benceno.
Una solución de 0,2 moles/L tiene un pH de 3,2-4,7.
En solución acuosa existe casi exclusivamente (∼ 99%) en forma de molécula HgCl2. Sin embargo, sufre algo de hidrólisis:
HgCl2 + H2O ⇔ Hg(OH)Cl + H+ + Cl–
HgCl2 + 2 H2O ⇔ Hg(OH)2 + 2 H+ + 2 Cl–,
Presenta una marcada solubilidad en solventes orgánicos, donde toma la forma de dímeros, es decir, dos moléculas unidas.
En presencia de materia orgánica y por acción de la luz solar se reduce formando cloruro de mercurio (I) (HgCl) y luego mercurio metálico.
HgCl2 + luz solar → HgCl → Hg0
Con solución de hidróxido de sodio (NaOH) genera un precipitado de color amarillo de óxido mercúrico (HgO).
Es incompatible o reacciona con formiatos, sulfitos, fosfatos, sulfuros, gelatina, albúmina, álcalis, amoníaco, hidróxido de calcio, bromuros, carbonatos, hierro, cobre, plomo, sales de plata y algunos materiales vegetales.
Debido entre otras cosas a su carácter más covalente que iónico, es ligeramente volátil a temperatura ambiente y se volatiliza apreciablemente a 100 °C.
Se puede preparar oxidando mercurio metálico (Hg0) con gas cloro (Cl2). Al calentar y llegar a más de 300 °C aparece una llama y se sublima un vapor que se recoge, y al enfriar se forman los cristales de HgCl2.
Hg + Cl2 + calor → HgCl2
También se obtiene calentando sulfato de mercurio (II) seco con cloruro de sodio. Los vapores de HgCl2 que subliman se recogen y se condensan a un sólido cristalino.
HgSO4 + 2 NaCl → HgCl2 + Na2SO4
La reacción entre el óxido de mercurio (II) con ácido clorhídrico en cantidades estequiométricas produce cristales de HgCl2 al enfriarse el medio.
HgO + 2 HCl → HgCl2 + H2O
Los cristales se pueden purificar por recristalización y sublimación.
Se emplea como reactivo en diversos análisis químicos. Permite la preparación de otros compuestos de mercurio, como yoduro de mercurio (II), óxido de mercurio (II), cloruro de mercurio (I), cloruro de amonio y mercurio (II).
Forma parte de la solución acética de Zenker, la cual es utilizada para tratar muestras o especímenes de biopsias de médula ósea. Los tejidos quedan fijados rápidamente con excelentes detalles histológicos para ser observados con el microscopio.

En la época medieval y hasta principios del XX se empleaba en diversas aplicaciones, pues se desconocía su efecto dañino para la salud.
- Como tratamiento de ciertas enfermedades, antiséptico tópico y desinfectante.
- En medicina veterinaria como agente cáustico, desinfectante y antiséptico.
- En agricultura actuaba como fungicida, para controlar lombrices de tierra, como insecticida y repelente de cucarachas, hormigas y termitas, y como desinfectante para proteger semillas y bulbos.
- Para la conservación de madera, agente químico para embalsamar y conservar muestras anatómicas.
- Como catalizador en la obtención de cloruro de vinilo a partir de acetileno.
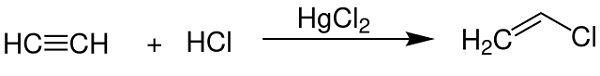
- En la electrodeposición de aluminio.
- Para marcar hierro y acero.
- Como reactivo de fotografía.
- En la impresión de telas, como mordiente para pelaje de conejo y castor, para el teñido de madera y fibras vegetales, y para curtir cuero.
- Como componente de baterías secas.
Es un compuesto corrosivo y extremadamente tóxico si se ingiere, pues puede causar la muerte. Ataca el tracto gastrointestinal y el sistema renal. Causa quemaduras severas en la piel y los ojos.
La exposición prolongada o repetida a este compuesto causa daño a los órganos internos. Todas las formas del mercurio son venenosas y el HgCl2 es una de las más tóxicas.
Se sospecha que es carcinógeno, que causa defectos genéticos y daños a la fertilidad.
Aunque no es combustible puede explotar al aplicarle calor. Cuando se descompone emite gases tóxicos de cloro y mercurio.
Las mezclas de HgCl2 con metales alcalinos como sodio o potasio son muy sensibles a golpes y pueden explotar con los impactos. Si entra en contacto con amoníaco, sulfuros, ácido oxálico y acetileno también puede explotar.
Es muy tóxico para los organismos acuáticos y terrestres, sus efectos se prolongan en el tiempo. Puede presentar bioacumulación a lo largo de toda la cadena alimenticia, tanto en plantas como animales.

Afecta la respiración, fotosíntesis y otros caminos metabólicos de las plantas causando su deterioro. No debe permitirse su disposición en el ambiente (ni agua ni suelos ni atmósfera).
A pesar de su toxicidad hay remedios naturales y hierbas que lo contienen, por lo que las personas, sin saberlo, se exponen peligrosamente a este compuesto.
Por ejemplo, en la medicina china tradicional el calomel o Qing Fen contiene algo de HgCl2. Es un remedio utilizado como diurético, antiséptico, ungüento para la piel, laxante y aplicado externamente para las molestias de la dentición en niños.

- U.S. National Library of Medicine. (2019). Mercuric chloride. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Lester, S.C. (2010). Specimen Processing. Zenker’s acetic fixative (Orange). In Manual of Surgical Pathology (Third Edition). Recuperado de sciencedirect.com.
- Clarkson, T.W. (2001). Agents. Physical and Chemical Properties. In Handbook of Pesticide Toxicology (Second Edition). Recuperado de sciencedirect.com.
- Fretham, S.J.B. et al. (2015). Mercury and Neurodegeneration. Natural Remedies and Herbs Containing Hg. In Bioactive Nutraceuticals and Dietary Supplements in Neurogical and Brain Disease. Recuperado de sciencedirect.com.
- Knight, S. et al. (2014). Distribution and Abundance of Aquatic Plants – Human Impacts. Chemical Pollutants. In Reference Module in Earth Systems and Environmental Sciences. Recuperado de sciencedirect.com.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Ciavatta, L. and Grimaldi, M. (1968). The Hydrolysis of Mercury(II) Chloride, HgCl2. Journal of Inorganic and Nuclear Chemistry, Volume 30, Issue 2, February 1968, Pages 563-581. Recuperado de sciencedirect.com.
- Wikimedia Foundation (2020). Mercury(II) Chloride. Recuperado de en.wikipedia.org.
