Calor de combustión: qué es, medición, ejemplos
¿Qué es el calor de combustión?
El calor de combustión es la energía liberada cuando una determinada cantidad de material, por lo general un mol, reacciona exotérmicamente con el oxígeno del aire. Se trata de una propiedad termoquímica imprescindible en la caracterización de los combustibles, alcoholes y, especialmente, hidrocarburos, tales como el butano y metano.
Cuando una sustancia se quema libera luz y calor, energía que puede aprovecharse para realizar trabajo sobre otros cuerpos. Por ejemplo, el calor generado es capaz de calentar grandes volúmenes de agua, cuyo vapor presiona los alrededores, accionando unos generadores eléctricos; o simplemente, calentando todavía más los alimentos cocinados al vapor.

El calor de combustión varía entre todas las sustancias, aun cuando su naturaleza química sea en esencia la misma. Esta variación corresponde a las estabilidades relativas, es decir: mientras más inestable sea un compuesto, mayor será la energía liberada, representada como -ΔH. El símbolo negativo significa que el calor fluye hacia afuera.
Diferentes valores de -ΔH se utilizan para comparar las estabilidades relativas entre distintos alcanos y sus isómeros. Asimismo, permite traslucir cuán estable es un compuesto oxigenado, como una cetona, frente a otro, un aldehído o ácido carboxílico.
Medición

Para medir los calores de combustión se necesita de una bomba calorimétrica. Dentro de ella la sustancia se hace reaccionar con el oxígeno por la activación de una chispa eléctrica.
Luego, el calor liberado calienta un volumen de agua que rodea el compartimiento de la muestra, midiéndose la temperatura antes y después de la combustión, así como la masa de agua y del combustible.
Entonces, la energía liberada será igual a:
CeH2o·mH2O·ΔT
Donde CeH2o es el calor específico del agua, 4.184 J/g·ºC, mH2O la masa del agua, y ΔT su cambio de temperatura. Finalmente, este calor, expresado en unidades de joule o calorías, se divide entre la masa o los moles del combustible colocado dentro de la bomba calorimétrica, para obtener así el calor de combustión por unidad de masa o de moles.
Los metales no combustionan en sí, sino que se oxidan a distintas velocidades dependiendo de la temperatura a la que estén expuestos. El calor que producen es despreciable como para ser medido de la misma manera como se hace con los hidrocarburos y otros combustibles. No son, por lo tanto, sustancias combustibles.
Energías potenciales
Durante la combustión los enlaces se rompen para formarse otros nuevos, más estables. La energía contenida en todos los enlaces de una molécula es independiente de su movimiento, por lo que se habla de una energía potencial.
Cuanto más grande sea la energía potencial, más inestable será la molécula y, por ende, liberará más calor una vez que se establezcan los nuevos enlaces.
Para saber cuáles con exactitud son estos nuevos enlaces, debe considerarse los productos de una combustión completa: CO2 para el carbono, H2O para el hidrógeno, y NO2 para el nitrógeno. En lo que concierne a los hidrocarburos, su combustión completa generará mezclas estequiométricas de CO2 y H2O.
Ambas moléculas, CO2 y H2O, tienen energías potenciales muy bajas, debido a que sus enlaces (O=C=O y H-O-H) son muy estables en comparación a los enlaces de los hidrocarburos de los que provinieron (C-H y C-C).
Estabilidades relativas
Las energías potenciales son inmedibles. Pero no lo son sus variaciones, es decir, la diferencia de esas energías entre los productos (CO2 y H2O) y los reactantes (hidrocarburos).
Es por eso que teniendo estas variaciones, o lo que es igual, sus calores de combustión, se puede saber cuáles son las estabilidades relativas entre un conjunto de hidrocarburos o isómeros.
Alcanos
Los alcanos pueden ser lineales, ramificados o cíclicos. En el caso de los alcanos lineales, su calor de combustión varía en función de la longitud de sus cadenas; es decir, depende de cuántas unidades CH2 tengan. Considérese el ejemplo del n-hexano, n-heptano y n-octano:
CH3(CH2)4CH3, -ΔH= 4163 kJ/mol
CH3(CH2)5CH3, -ΔH= 4817 kJ/mol
CH3(CH2)6CH3, -ΔH= 5471 kJ/mol
Se puede ver que sus calores de combustión varían por 654 kJ/mol. Esto significa que cada CH2 que se agrega a la cadena incrementa el calor de combustión a razón de 654 kJ/mol. Así, el nonano, CH3(CH2)7CH3, tendrá un calor de combustión igual a 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
Esto es lo mismo que decir que las cadenas más largas tienen mayores energías potenciales, y por consiguiente, son más inestables.
Los alcanos ramificados son más estables que los lineales, y esto se deduce a partir de sus calores de combustión. Considérese ahora el caso de tres isómeros del octano:
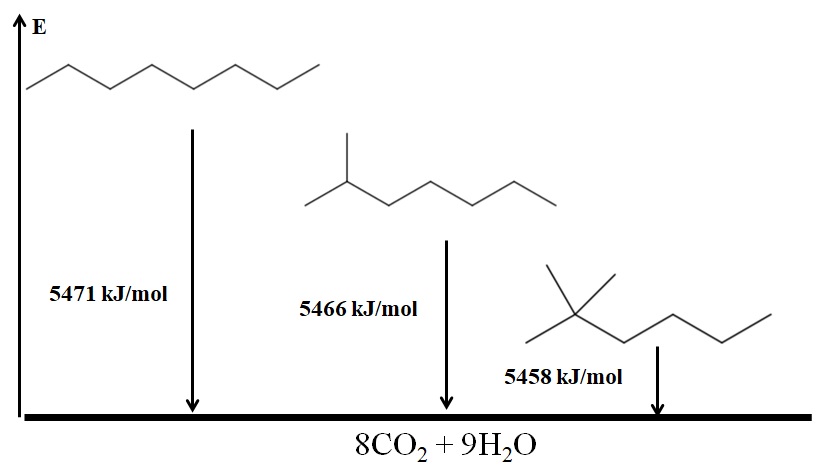
El n-octano es el más inestable porque su calor de combustión es el mayor (5471 kJ/mol). En cambio, los isómeros 2-metilheptano y 2,2-dimetilhexano tienen calores de combustión más bajos (5466 kJ/mol y 5458 kJ/mol, respectivamente) debido a que están ramificados. El 2,2-dimetilhexano es el más estable por ser el más ramificado de los tres isómeros.
Alquenos
Las estabilidades relativas de los alquenos también pueden obtenerse de sus calores de combustión. Considérese por ejemplo cuatro isómeros del buteno:
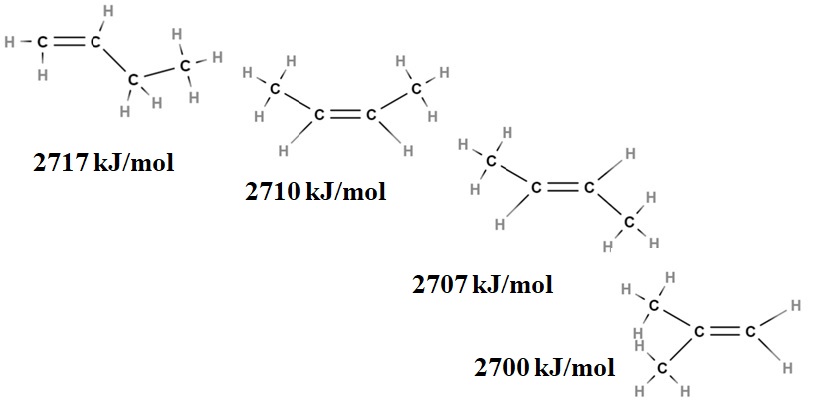
Aquí ya no se habla de ramificaciones, sino del grado de sustitución del doble enlace, C=C, y de sus tensiones de van der Waals; es decir, de las repulsiones electrónicas y estéricas entre dos grupos voluminosos ubicados en el mismo lado del doble enlace.
El primer isómero, 1-buteno, es el más inestable porque su doble enlace se encuentra menos sustituido (H2C=C). Esto se refleja en su calor de combustión de 2717 kJ/mol.
A la derecha, el cis-2-buteno, es un poco más estable debido a que su doble enlace está más sustituido. Pero el trans-2-buteno lo es más aún, porque aunque tenga el mismo grado de sustitución, los grupos CH3 del doble enlace están en posiciones trans, es decir, en distintos lados del doble enlace. Nótese que el calor del trans-2-buteno (2707 kJ/mol) apenas es un poco menor que el del cis-2-buteno (2710 kJ/mol).
El último isómero, el 2-metil-2-buteno, el cual también está igual de sustituido que el cis y trans 2 buteno, es sin embargo el más inestable de todos. Esto se debe a que ambos CH3 se encuentran en uno de los carbonos del doble enlace, tratándose por lo tanto de un alqueno con CH3 geminales.
Compuestos carbonílicos
Así como sucede con los alcanos, alquenos, y otros hidrocarburos en general, las estabilidades relativas de los compuestos carbonílicos (cetonas, aldehídos, ácidos carboxílicos) también se relacionan con sus calores de combustión.
Así, mientras más estabilizado, o menos reactivo sean sus grupos C=O, menores serán sus calores de combustión.
Por ejemplo, el calor de combustión del butanal, CH3CH2CH2CHO, es 2475 kJ/mol. Este calor es superior al de la 2-butanona, CH3CH2COCH3, el cual es igual a 2442 kJ/mol. Por lo tanto, el butanal es más inestable que la 2-butanona.
En la 2-butanona el C=O está más estabilizado gracias a los grupos CH3CH2 y CH3; cosa que no sucede con el butanal, donde uno de los grupos apenas es un átomo H.
Referencias
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Heat of combustion. Recuperado de: en.wikipedia.org
- CK-12 Foundation. Heat of combustion. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- BBC. (2020). Chemical energy: Enthalpy of combustion. Recuperado de: bbc.co.uk
- Steven A. Hardinger. (2017). Illustrated Glossary of Organic Chemistry: Enthalpy of combustion. Recuperado de: chem.ucla.edu
