¿Qué son los defectos puntuales? (Con ejemplos)
¿Qué son los defectos puntuales?
Los defectos puntuales son imperfecciones o irregularidades que se presentan en el retículo cristalino de un sólido, y que desvían la estructura cristalina de su estado perfecto. Se dice que no tienen dimensión (0) debido a que son solamente puntos del retículo cristalino; este punto puede ser un átomo, ion, molécula, clústeres, etc.
Los sólidos a una temperatura de 0 K (el cero absoluto) exhiben estructuras perfectas, pues en teoría sus componentes se encuentran inmovilizados, congelados. Sin embargo, apenas sube la temperatura los átomos, a decir, comienzan a vibrar, lo cual tarde o temprano acaba originando que se desplacen fuera de sus sitios correspondientes.
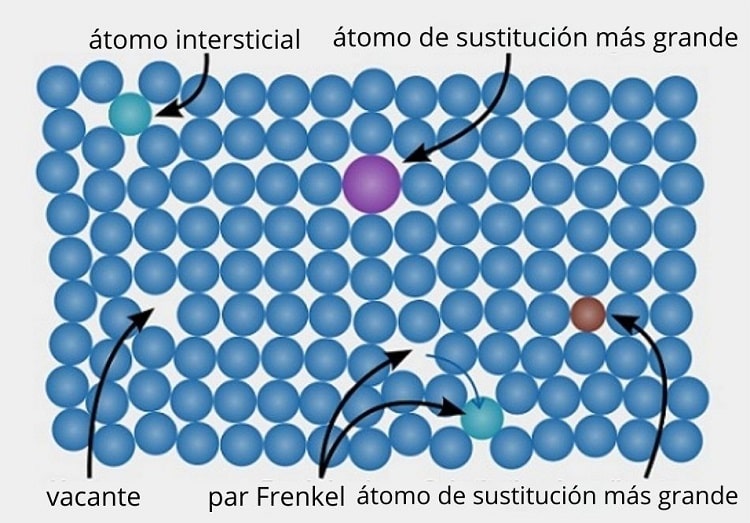
Veamos como ejemplo la imagen superior. En una estructura cristalina ordenada y perfecta, todos los puntos azulados deberían estar alineados. No obstante, algunos de los puntos azulados pueden estar ausentes, lo cual se observa por la presencia de un espacio vacío o una vacancia.
Si la formación de dicha vacancia se debe al desplazamiento de un punto azulado de su sitio original, tendremos un par de Frenkel, uno de los principales tipos de defectos puntuales que existen. El punto azulado movilizado se sitúa ahora en una posición intersticial (de color verde).
Por otro lado, los defectos puntuales también pueden deberse a sustituciones, ya sea por átomos más grandes (de color morado), o átomos más pequeños (de color marrón). Hablamos pues de defectos puntuales sustitucionales, que tienen lugar muchas veces cuando se introducen impurezas a propósito (dopado) en materiales metálicos y cerámicos.
Los defectos puntuales son esenciales para entender otros defectos que se proyectan en otras dimensiones del cristal.
Defectos puntuales intrínsecos
Cuando se define una estructura cristalina se hace siempre desde la idealidad. Pero en la naturaleza los defectos son inevitables, por pequeños que sean. Así, los sólidos tienen una predisposición natural a presentar defectos puntuales en sus estructuras, cuya interacción y sumatoria afectan o modifican sus propiedades químicas y físicas. Los llamados defectos puntuales intrínsecos tienen lugar en materiales “puros”.
Esta predisposición natural se debe a factores termodinámicos y cinéticos. La introducción de los defectos incrementa la entropía del sólido, que a su vez aumenta con la temperatura. Entonces, a una determinada temperatura cualquier sólido tendrá un estado con una configuración mínima de defectos puntuales.
A medida que aumenta la temperatura habrá todavía más defectos, habiendo la máxima cantidad posible en las cercanías del punto de fusión. Todo esto tiene sentido si se piensa que a mayores vibraciones térmicas, mayores serán las probabilidades de que los átomos abandonen sus respectivas posiciones reticulares.
Defectos puntuales extrínsecos
A diferencia de los defectos puntuales intrínsecos, los extrínsecos ocurren por la incorporación de impurezas. Ningún sólido en la naturaleza es 100% puro, por lo que siempre manifestará estos tipos de defectos, además de los intrínsecos.
Sin embargo, cobran una singular importancia e interés cuando las impurezas se adicionan intencionalmente en cantidades predeterminadas; hablamos del dopado de materiales.
Dependiendo de las características del dopante y del material seleccionado, se incorporan defectos en el sólido de manera premeditada, lo cual repercute en sus propiedades químicas y físicas. Tal es el caso de la formulación de semiconductores, por ejemplo, el GaAs.
Por otro lado, los defectos puntuales extrínsecos también aluden a aquellos que modifican la composición de los materiales o los sólidos. Es decir, pierden su estequiometría para volverse sólidos no estequiométricos.
Defectos puntuales en metales
En los metales tenemos cristales que, en principio, carecen de cargas eléctricas; es decir, no hay cationes ni aniones presentes, sino solamente átomos neutros metálicos. Entonces, los defectos que pudiera haber en los metales no afectarían su neutralidad, por lo que no tendría lugar ningún mecanismo que compense dichos defectos.

En la imagen de arriba tenemos un cristal perfecto y otros dos con defectos. Los átomos pueden ubicarse en posiciones intersticiales, lo cual desordena las posiciones de los átomos vecinos y se conoce como un defecto auto-intersticial (abajo en el centro). Mientras, algunos átomos son capaces de abandonar sus sitios respectivos del arreglo cristalino para generar vacancias (derecha).
Por lo tanto, en los metales puros es posible la existencia de defectos intrínsecos de vacancias y auto-intersticiales. Mientras más vacancias haya, la densidad de la sustancia disminuye; hecho que va en consonancia con el incremento del número de defectos con la temperatura.
Cuando, por otra parte, se dopa el metal con átomos de otro elemento, estos ocasionan sustituciones o buscan situarse en los intersticios. En tales casos, la densidad del metal se incrementa hasta un valor máximo, a partir del cual comienza a decaer drásticamente.
Defectos puntuales en estructuras cristalinas
En las estructuras cristalinas, abarcando otros sólidos además de los ya mencionados metales, tenemos dos tipos principales de defectos puntuales: los de Frenkel, y los de Schottky. Ambos pueden darse en mismas regiones de un cristal, y asimismo es bastante posible que estén presentes junto a defectos de vacancias o por ocupaciones intersticiales.
Cuando hablamos de sales, óxidos, sulfatos, etc., habrá cationes y aniones que definan un cristal por sus interacciones electrostáticas. Por lo tanto, si eliminamos un catión, predominarán las cargas negativas de los aniones, y el cristal se cargará negativamente. Esto es imposible que ocurra porque violaría el principio de la electroneutralidad.
Es así pues, que los defectos en este tipo de cristales generan cargas eléctricas, las cuales mediante un mecanismo deben volver a igualarse. Sin embargo, los defectos de Frenkel y Schottky no producen este desbalanceo de las cargas eléctricas.
Frenkel
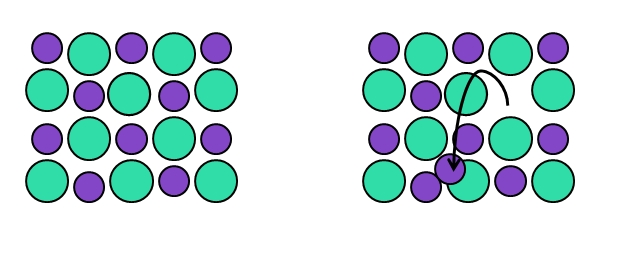
En el defecto puntual de tipo Frenkel, en honor a Yakov Frenkel, un punto reticular abandona su posición original para terminar en un intersticio. Es decir, que un átomo, molécula o ion pasan a una posición intersticial dejando atrás una vacancia.
Véase el ejemplo de la imagen de arriba. A la izquierda tenemos el cristal perfecto compuesto por dos iones: uno verde, que representa de ordinario al anión (más voluminoso), y uno morado, que viene a ser el catión (más pequeño).
Cuando uno de los cationes morados abandonan su posición del arreglo cristalino, deja atrás una vacancia. Nótese en la izquierda la dirección a la que apunta la flecha negra, señalando que el catión ahora se sitúa en un intersticio.
Debido a que el defecto de Frenkel consta de desplazamientos de cationes (o aniones), el cristal permanece neutro. Asimismo, la composición del cristal se mantiene constante, ya que en el retículo los iones están cambiando de posiciones: no lo están abandonando, ni otros se están sumando a él.
Schottky
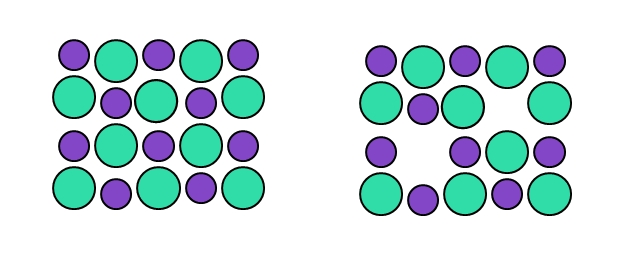
En el defecto puntual de tipo Schottky tenemos dos vacancias simultáneas: una correspondiente al catión, y otra correspondiente al anión. Por ejemplo, ahora no se trata de que un catión brinque a una posición intersticial, sino que “desaparece” acompañado de un anión (derecha de la imagen superior).
Nuevamente, al crearse dos vacancias al mismo tiempo, una catiónica (que se comportará como un anión), y una aniónica (que se comportará como un catión), la composición del cristal se mantiene inalterada. Esto es así siempre y cuando se hable de este tipo de defecto, y no de vacancias arbitrarias causadas por agentes externos o internos.
De todo lo anterior comentado se concluye que los defectos de Frenkel y Shottky son defectos puntuales intrínsecos de tipo estequiométricos, pues no alteran la composición o estequiometria de los sólidos.
Defectos puntuales en materiales cerámicos
Las cerámicas son materiales cuyo carácter iónico es muy oscilante. Algunas presentan un marcado carácter covalente, como sucede con la sílice, SiO2, o con el nitruro de aluminio, AlN.
Por lo tanto, debemos considerar otros dos tipos de defectos puntuales que pueden ocurrir como producto del carácter covalente de las cerámicas: el antisitio y el enlace no saturado.
Antisitio
Como su nombre sugiere, es el defecto que ocurre cuando dos átomos cambian de sitio, encontrándose en posiciones contrarias a la del retículo cristalino original. Por ejemplo, en el SiC puede ocurrir que haya enlaces C-C o Si-Si donde no debería de haberlos. Este tipo de defecto puntual es muy común también en aleaciones:
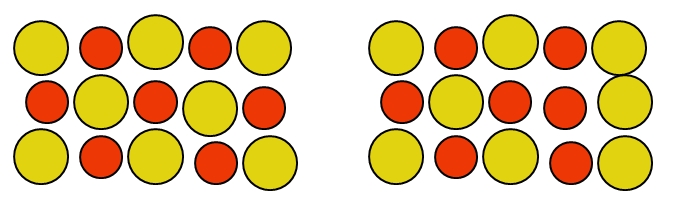
Nótese que los átomos de cobre y oro en la aleación Au-Cu son neutros. No importa cómo se desplacen, la neutralidad del cristal no se ve perturbada. Por ende, el que dos átomos cambien de sitio en el cristal, tal como en la derecha de la imagen de arriba, no afecta la neutralidad de la aleación.
En las cerámicas que poseen más de un catión, como en las espinelas, dos cationes con iguales valencias pueden intercambiar de sitio (por ejemplo Al3+ y Cr3+) sin que haya desbalanceo de las cargas eléctricas.
Enlace no saturado
El enlace no saturado (dangling bond en inglés) interrumpe el orden en los cristales de las cerámicas covalentes, ya que el átomo que forma el enlace está ausente, quedando un par de electrones libres.
En las cerámicas no solo se dan los defectos de antisitio y de enlace no saturado, sino también todos los defectos intrínsecos y extrínsecos, por lo que resulta complejo analizar sus estructuras reales, no perfectas.
Ejemplos de defectos puntuales
A lo largo del artículo se han mencionado algunos ejemplos de materiales y sus defectos puntuales. A continuación, y para finalizar, se enlistarán otros materiales, acompañados del tipo de defecto que usualmente presentan.
Haluros de plata
Los haluros de plata, como el AgCl o AgBr, presentan defectos de Frenkel donde el catión Ag+ se desplaza a posiciones intersticiales.
Haluros alcalinos
Los haluros alcalinos, como el NaCl, manifiestan defectos de Schottky, cuyas vacancias aniónicas se llenan de electrones cuando sus cristales se calientan en presencia de los vapores de sodio o potasio metálicos.
Dióxido de torio
En el ThO2 el catión Th4+ es más voluminoso que el anión O2-. Por lo tanto, este óxido presenta defecto de Frenkel donde es el O2- el que se desplaza a posiciones intersticiales.
Esponja de paladio
El paladio es capaz de absorber hidrógeno, comportándose como una esponja que los retiene en las posiciones intersticiales de sus cristales.
Aceros
De modo similar como sucede entre el paladio y el hidrógeno, el hierro puede incorporar en sus intersticios átomos de carbono, lo cual da lugar a la formación de los aceros.
Aleaciones de titanio
El defecto puntual sustitucional, aunque no se haya explicado como los otros defectos, no es más que la sustitución de un átomo por otro, lo cual rompe con el orden establecido por el cristal.
Así, por ejemplo, los átomos de un cristal de titanio pueden ser sustituidos por otros átomos (metálicos) para originar una familia de aleaciones de titanio.
Referencias
- Barry Carter & M. Grant Norton. (2007). Ceramic Materials Science and Engineering. Springer.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- B.S.H. Royce. (s.f.). Point Defects. Recuperado de: princeton.edu
- Wikipedia. (2020). Crystallographic defect. Recuperado de: en.wikipedia.org
- Nayak, S.K., Hung, C.J., Sharma, V. et al. (2018). Insight into point defects and impurities in titanium from first principles.npj Comput Mater 4,11. doi.org/10.1038/s41524-018-0068-9
- Byju’s. (2020). Point Defects. Recuperado de: byjus.com
