Microfilamentos: características, estructura, funciones, patología
Los microfilamentos o filamentos de actina, son uno de los tres componentes fundamentales del citoesqueleto de las células eucariotas (microfilamentos, microtúbulos y filamentos intermedios) y están compuestos de pequeños filamentos de una proteína llamada actina (polímeros de actina).
En los eucariotas, los genes que codifican para los microfilamentos de actina se encuentran altamente conservados en todos los organismos, por lo que muchas veces son empleados como marcadores moleculares para estudios de diversa índole.
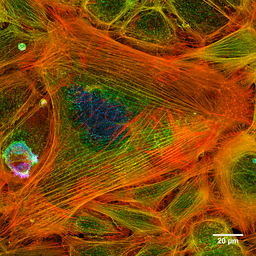
Los microfilamentos se distribuyen por todo el citosol, pero son especialmente abundantes en la región subyacente a la membrana plasmática, en donde forman una de red compleja y se asocian con otras proteínas especiales para conformar el citoesqueleto.
Las redes de microfilamentos en el citoplasma de las células de los mamíferos están codificadas por dos de los seis genes descritos para la actina, que están implicados en la dinámica de los microfilamentos y que incluso son muy importantes durante la diferenciación de las células madre.
Muchos autores concuerdan en que los microfilamentos son las proteínas más diversas, versátiles e importantes del citoesqueleto de la mayoría de las células eucariotas, y es importante recordar que estos no se encuentran en los microorganismos procariotas.
En este tipo de células, en cambio, se encuentran unos filamentos homólogos a los microfilamentos, pero que están formados por otra proteína: la proteína MreB.
En la actualidad, se piensa que el gen que codifica para esta proteína es un posible gen ancestral para la actina de los eucariotas. No obstante, la homología de secuencia de los aminoácidos que forman a la proteína MreB es sólo del 15% con respecto a la secuencia de la actina.
Como son parte fundamental del citoesqueleto, cualquier defecto fenotípico tanto en los microtúbulos como en los filamentos intermedios y los microfilamentos de actina (citoesqueleto) pueden causar distintas patologías celulares y sistémicas.
Índice del artículo
- 1 Características y estructura
- 2 ¿Cómo se forman los filamentos de actina?
- 3 Funciones
- 4 Patologías relacionadas
- 5 Referencias
Los microfilamentos están constituidos por monómeros de proteínas de la familia actina, que son proteínas contráctiles sumamente abundantes en las células eucariotas, puesto que también participan en la contracción muscular.
Estos filamentos tienen un diámetro entre los 5 y los 7 nm, por lo que también se conocen como filamentos delgados y están compuestos por dos formas de actina: la forma globular (actina G) y la forma filamentosa (actina F).
Las proteínas que participan en el citoesqueleto se conocen como actinas γ y β, mientras que las que participan en la contracción son, usualmente actinas α.
La proporción de actina globular y actina filamentosa en el citosol depende de las necesidades celulares, ya que los microfilamentos son estructuras muy variables y versátiles, que están en constante crecimiento y acortamiento por polimerización y despolimerización.
La actina G es una proteína globular de pequeño tamaño, conformada por casi 400 aminoácidos y de alrededor de 43 kDa de peso molecular.
Los monómeros de actina G que conforman los microfilamentos se ordenan en forma de hebra helicoidal, puesto que cada uno sufre una torsión cuando se asocia con el siguiente.
La actina G se asocia con una molécula de Ca2+ y con otra de ATP, que estabilizan su forma globular; mientras que la actina F se obtiene tras la hidrólisis del fosfato terminal de la molécula de ATP en la actina G, lo que contribuye a la polimerización.
Los filamentos de actina pueden organizarse en forma de “haces” o de “redes” que tienen distintas funciones en el interior de las células. Los haces forman estructuras paralelas unidas por puentes cruzados bastante rígidas.
Las redes, por otro lado, son estructuras más holgadas, como mallas tridimensionales con las propiedades de los geles semisólidos.
Existen muchas proteínas que se asocian con los filamentos de actina o microfilamentos y que se conocen como ABP (del inglés actin binding proteins), que poseen sitios específicos para ello.
Muchas de estas proteínas les permiten a los microfilamentos interactuar con los otros dos componentes del citoesqueleto: los microtúbulos y los filamentos intermedios, así como con los demás componentes de la cara interna de la membrana plasmática.
Entre otras de las proteínas con las que interactúan los microfilamentos se encuentran las láminas nucleares y la espectrina (en los glóbulos rojos).
Ya que los monómeros de actina globular se unen siempre de la misma forma, orientados en la misma dirección, los microfilamentos tienen una polaridad definida, con dos extremos: uno “más” y uno “menos”.
La polaridad de dichos filamentos es muy importante, puesto que estos crecen considerablemente más rápido por su extremo positivo, en donde se van agregando los nuevos monómeros de actina G.

Lo primero que tiene lugar durante la polimerización de los filamentos de actina es un proceso conocido como “nucleación”, que consiste en la asociación de tres monómeros de la proteína.
A este trímero se adicionan nuevos monómeros por ambos extremos, de modo que el filamento crece. Los monómeros de actina G son capaces de hidrolizar ATP con cada unión, lo que tiene implicaciones en la velocidad de la polimerización, puesto que las porciones actina-ATP se disocian con mayor dificultad que las de actina-ADP.
El ATP no es necesario para la polimerización y la función concreta de su hidrólisis aún no ha sido esclarecida.
Algunos autores consideran que, dado que los eventos de polimerización de actina son rápidamente reversibles, el ATP asociado con dichos procesos puede representar hasta 40% del recambio celular total de esta molécula energética.
Tanto la polimerización de los filamentos de actina como su despolimerización son procesos altamente regulados por una serie de proteínas específicas, que se encargan de la remodelación de los filamentos.
Ejemplo de las proteínas que regulan la despolimerización son el factor de despolimerización de actina cofilina. Otra proteína, la profilina, tiene una función contraria, puesto que estimula la asociación de los monómeros (mediante la estimulación del intercambio de ADP por ATP).
Los microfilamentos interactúan con los filamentos de miosina que están asociados con proteínas transmembranales que poseen un dominio en el citosol y otro en el exterior celular, por lo que participan en los procesos de movilidad celular.
Estos microfilamentos asociados con la membrana plasmática median diversas respuestas celulares a diferentes clases de estímulos. Por ejemplo, la adhesión celular de los tejidos epiteliales está dirigida por unas proteínas transmembranales conocidas como cadherinas, que interactúan con los microfilamentos para reclutar los factores de respuesta.
Los filamentos de actina interactúan con los filamentos intermedios para hacer que los estímulos extracelulares se transmitan a lugares claves como los ribosomas y los cromosomas en el interior del núcleo.
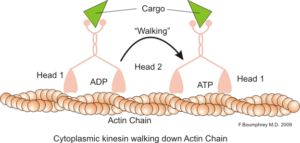
Una función clásica y muy estudiada de los microfilamentos es su capacidad de formar “puentes”, “rieles” o “autopistas” para el movimiento de la proteína motora miosina I, que es capaz de cargar vesículas de transporte desde los orgánulos hacia a la membrana plasmática en las vías secretoras.
Los microfilamentos también interaccionan con la miosina II para establecer el anillo contráctil que se forma durante la citocinesis, precisamente durante la última etapa de la división celular en la que se separa el citosol de las células madre e hija.
En general, los microfilamentos en forma de actina F modulan la distribución de algunos orgánulos como el complejo de Golgi, el retículo endoplásmico y las mitocondrias. Además, también participan en el posicionamiento espacial de los ARNm para que sean leídos por los ribosomas.
Todo el conjunto celular de microfilamentos, especialmente los que están estrechamente relacionados con la membrana plasmática, participan en la formación de las membranas ondulantes de las células que poseen un movimiento activo constante.
También participan en la formación de las microvellosidades y otras protuberancias comunes en la superficie de muchas células.
Los microfilamentos participan en el proceso de secreción de la bilis en los hepatocitos (células hepáticas) y también en los movimientos peristálticos (contracción coordinada) de los canalículos hepáticos.
Contribuyen a la diferenciación de dominios de membrana plasmática gracias a su asociación con diferentes elementos citosólicos y al control que ejercen sobre la topografía de estos elementos intracelulares.
Existen pocas enfermedades asociadas con defectos primarios en la estructura o con las proteínas y enzimas reguladoras en la síntesis de los microfilamentos, a pesar de que estos están directamente implicados en gran número de funciones.
El bajo índice de enfermedades y malformaciones en la estructura primaria de los microfilamentos se debe a que, generalmente, hay múltiples genes codificantes tanto de actina como de sus proteínas reguladoras, fenómeno conocido como “redundancia genética”.
Una de las patologías más estudiadas es la vitrificación de los ovocitos sobre su citoesqueleto, donde se observa una interrupción en la red de microfilamentos corticales, así como una despolimerización y una desorganización de los microtúbulos del huso mitótico.
En términos generales, esta vitrificación causa una dispersión cromosómica, puesto que conlleva a un desarreglo en la compactación de toda la cromatina.
Las células que poseen una mayor organización y proporción de microfilamentos en su citoesqueleto son las células del músculo estriado, por tanto, la mayoría de las patologías se asocian con un mal funcionamiento del aparato contráctil.
Microfilamentos defectuosos o atípicos han sido asociados también con la enfermedad de los huesos conocida como enfermedad de Paget.
- Aguilar-Cuenca, R., Llorente-González, C., Vicente, C., & Vicente-Manzanares, M. (2017). Microfilament-coordinated adhesion dynamics drives single cell migration and shapes whole tissues. F1000Research, 6.
- Dos Remedios, C. G., Chhabra, D., Kekic, M., Dedova, I. V., Tsubakihara, M., Berry, D. A., & Nosworthy, N. J. (2003). Actin binding proteins: regulation of cytoskeletal microfilaments. Physiological reviews, 83(2), 433-473.
- Guo, H., Fauci, L., Shelley, M., & Kanso, E. (2018). Bistability in the synchronization of actuated microfilaments. Journal of Fluid Mechanics, 836, 304-323.
- Lanza, R., Langer, R., & Vacanti, J. P. (Eds.). (2011). Principles of tissue engineering. Academic press.
- Robbins, J. (2017). Diseases of the Cytoskeleton: The Desminopathies. In Cardioskeletal Myopathies in Children and Young Adults (pp. 173-192). Academic Press.
