Proceso isocórico: concepto, fórmulas, cálculo, ejemplos
¿Qué es un proceso isocórico?
Un proceso isocórico es todo proceso de carácter termodinámico en el cual el volumen permanece constante. Estos procesos con frecuencia también reciben el nombre de isométricos o isovolumétricos. En general, un proceso termodinámico puede ocurrir a presión constante y entonces se denomina isobárico.
Cuando ocurre a temperatura constante, en ese caso se dice que es un proceso isotérmico. Si no se produce intercambio de calor entre el sistema y el entorno, entonces se habla de adiabáticos. En cambio, cuando hay un volumen constante, el proceso generado se denomina isocórico.
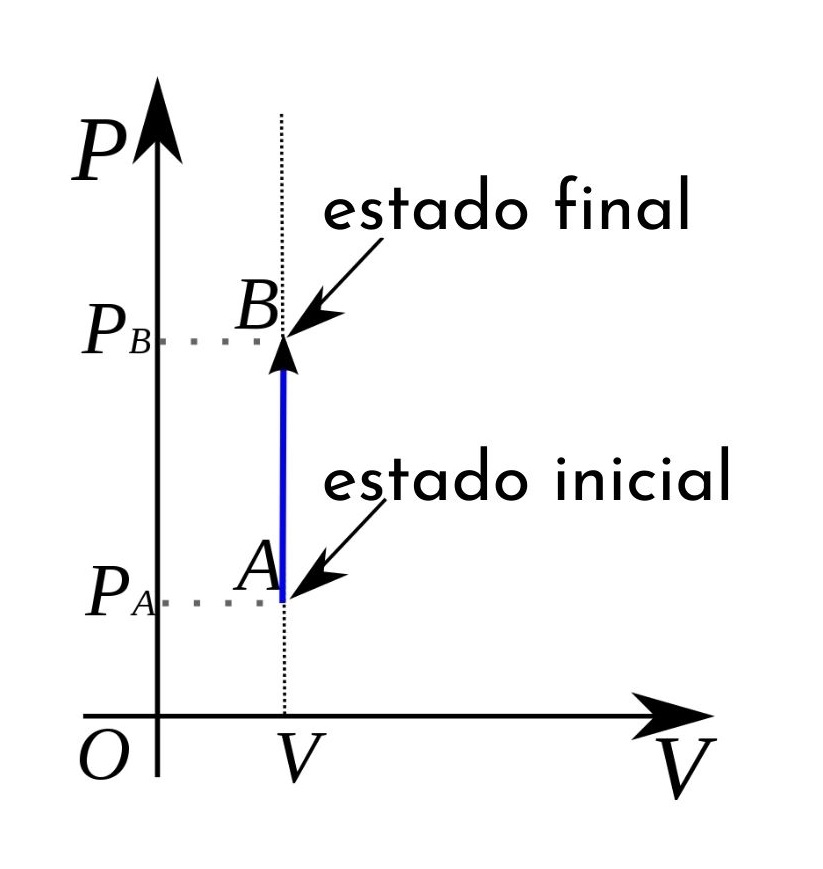
En el caso del proceso isocórico, se puede afirmar que en estos procesos el trabajo presión-volumen es nulo, ya que este resulta de multiplicar la presión por el incremento de volumen.
Además, en un diagrama termodinámico de presión-volumen los procesos isocóricos aparecen representados en forma de línea recta vertical.
Fórmulas y cálculo
El primer principio de la termodinámica
En termodinámica se calcula el trabajo a partir de la siguiente expresión:
W = P ∙ ∆ V
En esta expresión W es el trabajo medido en Julios, P la presión medida en Newton por metro cuadrado, y ∆ V es la variación o incremento de volumen medida en metros cúbicos.
Igualmente, el conocido como primer principio de la termodinámica establece que:
∆ U = Q – W
En dicha fórmula W es el trabajo realizado por el sistema o sobre el sistema, Q es el calor recibido o emitido por el sistema, y ∆ U es la variación de energía interna del sistema. En esta ocasión las tres magnitudes se miden en Julios.
Dado que en un proceso isocórico el trabajo resulta nulo, resulta que se cumple que:
∆ U = QV (ya que, ∆ V = 0, y por tanto W = 0)
Es decir, que la variación de energía interna del sistema se debe únicamente al intercambio de calor entre el sistema y el ambiente. En este caso, al calor transferido se le denomina calor a volumen constante.
La capacidad calorífica de un cuerpo o sistema resulta de dividir la cantidad de energía en forma de calor transferida a un cuerpo o a un sistema en un proceso determinado y el cambio de temperatura experimentado por el mismo.
Cuando el proceso se realiza a volumen constante, se habla de capacidad calorífica a volumen constante y se denota por Cv (capacidad calorífica molar).
Se cumplirá en ese caso:
Qv = n ∙ Cv ∙ ∆T
En dicha situación, n es el número de moles, Cv es la ya mencionada capacidad calorífica molar a volumen constante y ∆T es el incremento de temperatura experimentado por el cuerpo o sistema.
Ejemplos cotidianos de procesos isocóricos
Es fácil imaginar un proceso isocórico, únicamente es necesario pensar en un proceso que ocurre a volumen constante; es decir, en el que el recipiente que contiene a la materia o sistema material no cambia de volumen.
Un ejemplo podría ser el caso un gas (ideal) encerrado en un recipiente cerrado cuyo volumen no se puede alterar por ningún medio al que se le suministra calor. Supóngase el caso de un gas encerrado en una botella.
Al transferirle calor al gas, como ya se ha explicado, acabará redundando en un incremento o aumento de su energía interna.
El proceso inverso sería el de un gas encerrado en un recipiente cuyo volumen no se puede modificar. Si el gas se enfría y cede calor al ambiente, entonces se reduciría la presión del gas y el valor de la energía interna del gas disminuiría.
El ciclo ideal Otto
El ciclo de Otto es un caso ideal del ciclo que utilizan las máquinas de gasolina. Sin embargo, su utilización inicial fue en las máquinas que empleaban gas natural u otro tipo de combustibles en estado gaseoso.
En cualquier caso, el ciclo ideal de Otto es un ejemplo interesante de proceso isocórico. Se produce cuando en un automóvil de combustión interna tiene lugar de forma instantánea la combustión de la mezcla de gasolina y aire.
En ese caso, tiene lugar un aumento de la temperatura y de la presión del gas dentro del cilindro, permaneciendo el volumen constante.
Ejemplos prácticos
Primer ejemplo
Dado un gas (ideal) encerrado en un cilindro provisto de un pistón, indique si los siguientes casos son ejemplos de procesos isocóricos.
– Se realiza un trabajo de 500 J sobre el gas.
En este caso no sería un proceso isocórico porque para realizar un trabajo sobre el gas es necesario comprimirlo, y por tanto, alterar su volumen.
– El gas se expande desplazando horizontalmente el pistón.
Nuevamente no sería un proceso isocórico, dado que la expansión del gas implica una variación de su volumen.
– Se fija el pistón del cilindro para que no se pueda desplazar y se enfría el gas.
En esta ocasión sí que se trataría de un proceso isocórico, puesto que no se daría una variación de volumen.
Segundo ejemplo
Determine la variación de energía interna que experimentará un gas contenido en un recipiente con un volumen de 10 L sometido a 1 atm de presión, si su temperatura se eleva desde 34 ºC hasta 60 ºC en un proceso isocórico, conocido su calor específico molar Cv = 2.5·R (siendo R = 8.31 J/mol·K).
Dado que se trata de un proceso a volumen constante, la variación de energía interna únicamente se producirá como consecuencia del calor suministrado al gas. Este se determina con la siguiente fórmula:
Qv = n ∙ Cv ∙ ∆T
Para poder calcular el calor suministrado, en primer lugar es necesario calcular los moles de gas contenidos en el recipiente. Para ello se hace necesario recurrir a la ecuación de los gases ideales:
P ∙ V = n ∙ R ∙ T
En esta ecuación n es el número de moles, R es una constante cuyo valor es 8,31 J/mol·K, T es la temperatura, P es la presión a la que está sometido el gas medida en atmósferas y T es la temperatura medida en Kelvin.
Se despeja n y se obtiene:
n = R ∙ T / (P ∙ V ) = 0, 39 moles
De modo que:
∆ U = QV = n ∙ Cv ∙ ∆T = 0,39 ∙2,5 ∙ 8,31 ∙ 26 = 210,65 J
