Reacciones químicas: características, partes, tipos, ejemplos
Las reacciones químicas son cambios que sufre la materia en el ordenamiento de sus átomos, y tienen lugar cuando dos sustancias o compuestos diferentes entran en contacto. En el proceso se originan cambios que pueden percibirse inmediatamente; tales como un incremento de la temperatura, enfriamiento, formación de gases, destellos o precipitación de un sólido.
Las reacciones químicas más comunes pasan a menudo desapercibidas en la vida diaria; en nuestros cuerpos se llevan a cabo miles de ellas. Otras, no obstante, son más visibles, pues podemos realizarlas en la cocina seleccionando los utensilios e ingredientes correctos; por ejemplo, mezclar bicarbonato con vinagre, derretir el azúcar en agua o acidificar el jugo de col morada.

En los laboratorios las reacciones químicas se vuelven más usuales y comunes; todas ocurren dentro de vasos de precipitados (beakers), o de matraces Erlenmeyer. Si algo comparten en común, es que ninguna es simple, pues esconden colisiones, rompimientos de enlaces, mecanismos, formación de enlaces, aspectos energéticos y cinéticos.
Hay reacciones químicas tan llamativas que los aficionados y científicos, conociendo la toxicología de los reactivos y algunas medidas de seguridad, las reproducen a grandes escalas en actos de demostración fascinantes.
Índice del artículo
- 1 Concepto de reacción química
- 2 Características de las reacciones químicas
- 3 Partes de una reacción química
- 4 Tipos de reacciones químicas
- 5 Ejemplos de reacciones químicas
- 6 Ejercicios de reacciones químicas resueltos
- 7 Referencias
Las reacciones químicas tienen lugar cuando existe el rompimiento de un enlace (iónico o covalente), para que se forme otro en su lugar; dos átomos o un conjunto de ellos dejan de interactuar fuertemente para originar nuevas moléculas. Gracias a esto puede determinarse las propiedades químicas de un compuesto, su reactividad, estabilidad, con qué reacciona.
Además de ser responsables las reacciones químicas de que la materia constantemente se transforme, sin verse afectados sus átomos, explican el surgimiento de los compuestos tales como los conocemos.
Para que se rompan los enlaces se requiere energía, y cuando se forman los enlaces esta se libera. Si es mayor la energía absorbida que la liberada, se dice que la reacción es endotérmica; tenemos un enfriamiento de los alrededores. Mientras que si el calor liberado es superior al absorbido, entonces se tratará de una reacción exotérmica; se calientan los alrededores.
Las moléculas en teoría deben colisionar unas con otras, llevando consigo la suficiente energía cinética para favorecer el rompimiento de un enlace. Si sus colisiones son lentas o ineficientes, la reacción química se ve afectada cinéticamente. Esto puede ocurrir bien sea por los estados físicos de las sustancias, o por la geometría o estructura de las mismas.
Así, en una reacción la materia se transforma absorbiendo o liberando calor, a la vez que sufre colisiones que favorecen la formación de los productos; los componentes más importante de toda reacción química.
Debido a la ley de conservación de la masa, la masa total del conjunto permanece constante después de una reacción química. Así, la suma de las masas individuales de cada sustancia es igual a la masa del resultado obtenido.
La ocurrencia de una reacción química puede ir acompañada de un cambio de estado de los componentes; es decir, una variación en el estado sólido, líquido o gaseoso del material.
Sin embargo, no todos los cambios de estado implican una reacción química. Por ejemplo: si el agua se evapora por efecto del calor, el vapor de agua producido tras este cambio de estado sigue siendo agua.
Entre los atributos físicos que resultan de una reacción química, destaca el cambio en el color de los reactivos versus el color del producto final.
Este fenómeno es apreciable al observar la reacción química de los metales con el oxígeno: cuando un metal se oxida, cambia su color característico (dorado o plateado, según sea el caso), para tornarse de un tono naranja-rojizo, conocido como herrumbre.
Esta característica se manifiesta como un burbujeo o con la emisión de olores particulares.
Generalmente, las burbujas aparecen como consecuencia del sometimiento de un líquido a altas temperaturas, lo cual incita un incremento de la energía cinética de las moléculas que forman parte de la reacción.
En caso de que el calor sea un catalizador de la reacción química, se inducirá en el producto final un cambio en la temperatura. Por ende, la entrada y la salida de calor en el proceso también puede ser una característica de las reacciones químicas.
Una reacción química cualquiera se representa por una ecuación del tipo:
A + B → C + D
Donde A y B son los reactantes, mientras C y D los productos. La ecuación nos dice que el átomo o molécula A, reacciona con B para originar productos C y D. Esta es una reacción irreversible, ya que los reactantes no pueden volver a originarse a partir de los productos. En cambio, la reacción de aquí abajo sí es reversible:
A + B => C + D
Es importante recalcar que la masa de los reactantes (A+B) debe ser igual a la masa de los productos (C+D). De lo contrario, la masa no se conservaría. Igualmente, el número de átomos para un elemento dado debe ser el mismo antes y después de la flecha.
Encima de la flecha se indica algunas especificaciones propias de la reacción: la temperatura (Δ), la incidencia de radiación ultravioleta (hv), o el catalizador usado.
En lo que concierne a la vida y a las reacciones que ocurren en nuestros cuerpos, el medio de reacción es acuoso (ac). Sin embargo, las reacciones químicas pueden desarrollarse en cualquier medio líquido (etanol, ácido acético glacial, tolueno, tetrahidrofurano, etc.) siempre y cuando los reactivos estén bien disueltos.
Las reacciones químicas controladas ocurren en un recipiente, ya sea un simple material de vidrio, o en un reactor de acero inoxidable.
Los tipos de reacciones químicas se basan en qué ocurre a nivel molecular; qué enlaces se rompen y cómo terminan uniéndose los átomos. Asimismo, se toma en consideración si las especies ganan o pierden electrones; aun cuando en la mayoría de las reacciones químicas ocurre esto.
A continuación te explicamos los distintos tipos de reacciones químicas que existen.
Oxidación del cobre
En el ejemplo de la pátina toma lugar una reacción de oxidación: el cobre metálico pierde electrones en presencia del oxígeno para transformarse en su óxido correspondiente.
4Cu(s) + O2(g) => Cu2O(s)
El óxido de cobre (I) continúa oxidándose para dar óxido de cobre (II):
2Cu2O(s) + O2 => 4CuO(s)
Este tipo de reacción química en donde las especies aumentan o reducen su número (o estado) de oxidación, se conoce como reacción de oxidación y reducción (rédox).
El cobre metálico con estado de oxidación 0, pierde primero un electrón, y luego el segundo (se oxida), mientras que el oxígeno se los queda (se reduce):
Cu => Cu+ + e–
Cu+ => Cu2+ + e–
O2 + 2e– => 2O2-
La ganancia o pérdida de electrones puede determinarse calculando los números de oxidación para los átomos en las fórmulas químicas de sus compuestos resultantes.
Para el Cu2O, se sabe que por ser un óxido se tiene al anión O2-, por lo que para mantener las cargas neutralizadas cada uno de los dos átomos de cobre debe tener carga de +1. Muy similar ocurre con el CuO.
El cobre al oxidarse adquiere números de oxidación positivos; y el oxígeno, por reducirse, números de oxidación negativos.
Hierro y cobalto
Se muestran a continuación ejemplos adicionales para las reacciones rédox. Asimismo, se hará un breve comentario y se especificarán los cambios en los números de oxidación.
FeCl2 + CoCl3 => FeCl3 + CoCl2
Si se calcula los números de oxidación, se notará que los del Cl permanecen con un valor constante de -1; no así, con los del Fe y Co.
A primera vista, el hierro se ha oxidado mientras que el cobalto se ha reducido. ¿Cómo saberlo? Porque el hierro interacciona ahora no con dos aniones Cl– sino con tres, siendo el átomo de cloro (neutro) más electronegativo que el hierro y el cobalto. Por otro lado, al cobalto le sucede lo contrario: pasa de interaccionar con tres Cl– a dos de ellos.
Si el anterior razonamiento no está claro, se procede entonces a escribir las ecuaciones químicas de la transferencia neta de los electrones:
Fe2+ => Fe3+ + e–
Co3+ + e– => Co2+
Por lo tanto el Fe2+ se oxida, mientras que el Co3+ se reduce.
Yodo y manganeso
6KMnO4 + 5KI + 18HCl => 6MnCl2 + 5KIO3 + 6KCl+ 9H2O
La ecuación química de arriba puede parecer complicada, pero no lo es. El cloro (Cl–) ni el oxígeno (O2-) experimentan ganancia o pérdida de sus electrones. El yodo y manganeso, sí.
Considerando solamente los compuestos con yodo y manganeso se tiene:
KI => KIO3 (número de oxidación: -1 a +5, pierde seis electrones)
KMnO4 => MnCl2 (número de oxidación: +7 a +2, gana cinco electrones)
El yodo se oxida, mientras que el manganeso se reduce. ¿Cómo saberlo sin hacer cálculos? Porque el yodo pasa de estar con el potasio a interaccionar con tres oxígenos (más electronegativos); y el manganeso, por su parte, pierde interacciones con el oxígeno para estar con el cloro (menos electronegativo).
El KI no puede perder seis electrones si el KMnO4 gana cinco; es por eso que debe balancearse en la ecuación el número de electrones:
5(KI => KIO3 + 6e–)
6 (KMnO4 + 5e– => MnCl2)
Lo que da lugar a una transferencia neta de 30 electrones.
Combustión
La combustión es una oxidación vigorosa y enérgica en la que se libera luz y calor. Generalmente, en este tipo de reacción química participa el oxígeno como agente oxidante o comburente; mientras que el agente reductor es el combustible, lo que arde al final de cuenta.
Donde hay cenizas, hubo combustión. Estas se componen en esencia de carbón y óxidos metálicos; aunque su composición lógicamente depende de cuál fue el combustible. Abajo se muestran unos ejemplos:
C(s) + O2(g) => CO2(g)
2CO(g) + O2(g) => 2CO2(g)
C3H8(g) + 5O2(g) => 3CO2(g) + 4H2O(g)
Cada una de estas ecuaciones corresponden a combustiones completas; es decir, todo el combustible reacciona con un exceso de oxígeno para garantizar su completa transformación.
Asimismo, cabe resaltar que el CO2 y H2O son los productos mayoritarios gaseosos cuando arden cuerpos carbonados (como la madera, hidrocarburos y los tejidos de animales). Es inevitable que se forme algún alótropo de carbón, a causa de una insuficiencia de oxígeno, al igual que gases menos oxigenados como CO y NO.

En la imagen superior se muestra una representación sobremanera sencilla. Cada triángulo es un compuesto o átomo, los cuales se unen para formar un solo compuesto; dos triángulos forman un paralelogramo. Las masas aumentan y las propiedades físicas y químicas del producto son, muchas veces, muy diferentes a las de sus reactivos.
Por ejemplo, la combustión del hidrógeno (la cual también es una reacción rédox), produce óxido de hidrógeno o hidruro de oxígeno; más conocido como agua:
H2(g) + O2(g) => 2H2O(g)
Al mezclar ambos gases, a una temperatura elevada, arden produciendo agua gaseosa. Enfriadas las temperaturas, los vapores se condensan para dar agua líquida. Varios autores consideran esta reacción de síntesis como una de las posibles alternativas para sustituir los combustibles fósiles en la obtención de energía.
Los enlaces del H-H y O=O se rompen para formar dos nuevos enlaces simples: H-O-H. El agua, como bien se sabe, es una sustancia inigualable (más allá del sentido romántico), y sus propiedades difieren bastante del hidrógeno y oxígeno gaseosos.
Compuestos iónicos
La formación de compuestos iónicos a partir de sus elementos también es un ejemplo de una reacción de síntesis. Una de las más simples es la formación de halogenuros de metales de los grupos 1 y 2. Por ejemplo, la síntesis del bromuro de calcio:
Ca(s) + Br2(l) => CaBr2(s)
Una ecuación general para este tipo de síntesis es:
M(s) + X2 => MX2(s)
Coordinación
Cuando el compuesto formado involucra un átomo metálico dentro de una geometría electrónica, se dice entonces que se trata de un complejo. En los complejos, los metales permanecen unidos con los ligandos mediante enlaces covalentes débiles, y se forman mediante reacciones de coordinación.
Por ejemplo, se tiene el complejo [Cr(NH3)6]3+. Este se forma cuando el catión Cr3+ está en presencia de las moléculas de amoníaco, NH3, las cuales actúan como ligandos del cromo:
Cr3+ + 6NH3 => [Cr(NH3)6]3+
Abajo se muestra el octaedro de coordinación resultante entorno al centro metálico de cromo:

Nótese que la carga 3+ del cromo no se neutraliza en el complejo. Su color es púrpura, y es por eso que el octaedro se representa con dicho color.
Algunos complejos son más interesantes, como en el caso de ciertas enzimas que coordinan átomos de hierro, zinc y calcio.
La descomposición viene a ser lo opuesto a la síntesis: un compuesto se descompone en uno, dos o tres elementos o compuestos.
Por ejemplo, se tienen las siguientes tres descomposiciones:
2HgO(s) => 2Hg(l) + O2(g)
2H2O2(l) => 2H2O(l) + O2(g)
H2CO3(ac) => CO2(g) + H2O(l)
El HgO es un sólido rojizo que por acción del calor se descompone en mercurio metálico, líquido de color negro, y oxígeno.
El agua oxigenada o peróxido de hidrógeno sufre descomposición, dando agua líquida y oxígeno.
Y el ácido carbónico, por su parte, se descompone en dióxido de carbono y agua líquida.
Una descomposición más “seca” es la que sufren los carbonatos metálicos:
CaCO3(s) => CaO(s) + CO2(g)
Volcán de la clase

Una reacción de descomposición que se ha utilizado en las clases de química es la descomposición térmica del dicromato de amonio, (NH4)2Cr2O7. Esta sal cancerígena de color anaranjado (por lo que debe manejarse con sumo cuidado), arde para liberar mucho calor y producir un sólido de color verde, el óxido crómico, Cr2O3:
(NH4)2Cr2O7(s) => Cr2O3(s) + 4H2O(g) + N2(g)
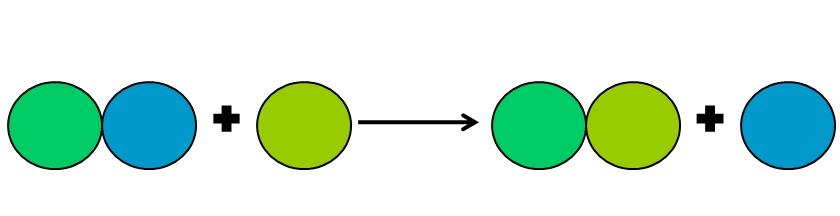
Las reacciones de desplazamiento son un tipo de reacción rédox en la que un elemento desplaza a otro en un compuesto. El elemento desplazado termina reduciéndose o ganando electrones.
Para simplificar lo anterior, se muestra la imagen superior. Los círculos representan un elemento. Se observa que el círculo de color verde lima desplaza al de color azul, quedando por fuera; pero no solo eso, sino que el círculo azul se reduce en el proceso, y el de verde lima se oxida.
Del hidrógeno
Se tiene por ejemplo las siguientes ecuaciones químicas para exponer lo anterior explicado:
2Al(s) + 6HCl(ac) => AlCl3(ac) + 3H2(g)
Zr(s) + 2H2O(g) => ZrO2(s) + 2H2(g)
Zn(s) + H2SO4(ac) => ZnSO4(ac) + H2(g)
¿Cuál es el elemento desplazado para estas tres reacciones químicas? El hidrógeno, el cual se reduce a hidrógeno molecular, H2; pasa de un número de oxidación de +1 a 0. Nótese que los metales aluminio, zirconio y zinc pueden desplazar a los hidrógenos de los ácidos y del agua; mientras que el cobre, ni la plata o el oro, no pueden.
De metales y halógenos
Igualmente, se tienen estas dos reacciones de desplazamiento adicionales:
Zn(s) + CuSO4(ac) => Cu(s) + ZnSO4(ac)
Cl2(g) + 2NaI(ac) => 2NaCl(ac) + I2(s)
En la primera reacción el zinc desplaza al metal menos activo cobre; el zinc se oxida mientras que el cobre se reduce.
En la segunda reacción, por otro lado, el cloro, elemento más reactivo que el yodo, desplaza a este último en la sal de sodio. Aquí ocurre al revés: el elemento más reactivo se reduce oxidando al elemento desplazado; por lo tanto, el cloro se reduce oxidando al yodo.
En las reacciones pudo verse que varias de ellas generaban gases, y por lo tanto, entran también en este tipo de reacción química. Asimismo, las reacciones del apartado anterior, la de desplazamiento de hidrógeno por un metal activo, se consideran reacciones de formación de gases.
Además de las ya mencionadas, los sulfuros metálicos, por ejemplo, liberan sulfuro de hidrógeno (el cual huele a huevos podridos) cuando se les adiciona ácido clorhídrico:
Na2S(s) + 2HCl(ac) => 2NaCl(ac) + H2S(g)
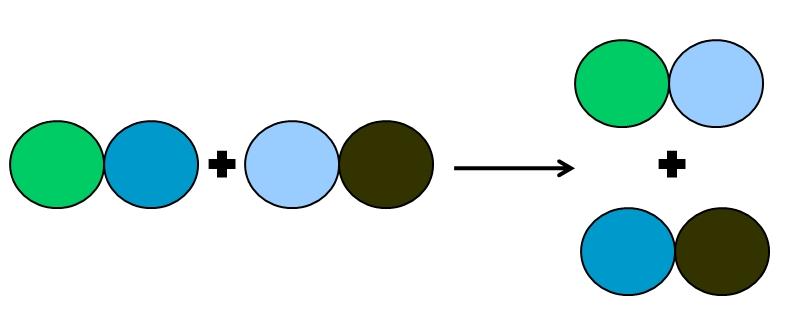
En la reacción de metátesis o doble desplazamiento lo que ocurre es un cambio de parejas sin transferencias de electrones; es decir, no se considera una reacción rédox. Como se aprecia en la imagen superior, el círculo verde rompe enlace con el de azul oscuro para enlazarse al círculo de azul claro.
Precipitación
Cuando las interacciones de una de las parejas son lo suficiente fuertes para vencer el efecto de solvatación del líquido, se obtiene un precipitado. Las siguientes ecuaciones químicas representan reacciones de precipitación:
AgNO3(ac) + NaCl(ac) => AgCl(s) + NaNO3(ac)
CaCl2(ac) + Na2CO3(ac) => CaCO3(s) + 2NaCl(ac)
En la primera reacción el Cl– desplaza al NO3– para formar cloruro de plata, AgCl, el cual es un precipitado blanco. Y en la segunda reacción, el CO32- desplaza al Cl– para precipitar carbonato de calcio.
Ácido base
Quizás la más emblemática de las reacciones de metátesis es la de neutralización ácido base. Para finalizar, se muestran dos reacciones ácido base como ejemplos:
HCl(ac) + NaOH(ac) => NaCl(ac) + H2O(l)
2HCl(ac) + Ba(OH)2(ac) => BaCl2(ac) + 2H2O(l)
Los OH– desplazan a los Cl– para formar agua y sales de cloruros.
Abajo y a continuación se hará mención de algunas reacciones químicas con sus respectivas ecuaciones y comentarios.
Zn(s) + AgNO3(ac) → 2Ag(s) + Zn(NO3)2(ac)
El zinc desplaza a la plata en su sal de nitrato: la reduce de Ag+ a Ag. Como resultado, comienza a precipitar plata metálica en el medio, observada al microscopio cual árboles plateados sin hojas. Por otro lado, el nitrato se combina con los iones Zn2+ resultantes para formar nitrato de zinc.
CaCO3(s) + 2HCl(ac) → CaCl2(ac) + H2O(l) + CO2(g)
El ácido clorhídrico neutraliza a la sal carbonato de calcio para producir una sal, cloruro de calcio, agua y dióxido de carbono. El CO2 burbujea y se le detecta en el agua. Este burbujeo se obtiene también al añadirle HCl a la tiza o a las cáscaras de huevo, ricas en CaCO3.
NH3(g) + HCl(g) → NH4Cl(s)
En esta segunda reacción, los vapores de HCl neutralizan al amoníaco gaseoso. La sal cloruro de amonio, NH4Cl, se forma como un humo blancuzco (imagen inferior), pues contiene finísimas partículas suspendidas en el aire.

AgNO3(ac) + NaCl(ac) → AgCl(s) + NaNO3(ac)
En una reacción de doble desplazamiento hay un intercambio de “parejas”. La plata cambia de pareja con el sodio. El resultado es que la nueva sal, cloruro de plata, AgCl, precipita como un sólido lechoso.

Hay innumerables reacciones rédox. Una de las más impresionantes es la de Barkin Dog:
8 N2O(g) + 4 CS2(l) → S8(s) + 4 CO2(g) + 8 N2(g)
Es tanta la energía liberada al formarse los tres productos estables, que se produce un destello azulado (imagen superior) y un incremento rotundo de la presión causada por los gases originados (CO2 y N2).
Y además, todo esto viene acompañado por un sonido fortísimo parecido al ladrido de un perro. El azufre producido, S8, recubre de amarillo las paredes internas del tubo.
¿Cuál especie se reduce y cuál se oxida? Como regla general, los elementos tienen número de oxidación 0. Por lo tanto, el azufre y el nitrógeno en los productos deben ser las especies que ganaron o perdieron electrones.
El azufre se oxidó (perdió electrones), pues tenía número de oxidación -2 en el CS2 (C4+S22-):
S2- → S0 + 2e–
Mientras que el nitrógeno se redujo (ganó electrones), porque tenía número de oxidación +1 en el N2O (N2+O2-):
2N+ + 2e → N0
¿Qué sal precipita en la siguiente reacción en medio acuoso?
Na2S(ac) + FeSO4(ac) → ¿?
Como regla general, todos los sulfuros, a excepción de formados con los metales alcalinos y amonio, precipitan en medio acuoso. Ocurre un doble desplazamiento: el hierro se une al sulfuro, y el sodio con el sulfato:
Na2S(ac) + FeSO4(ac) → FeS(s) + Na2SO4(ac)
¿Qué productos obtendremos de la siguiente reacción?
Cu(NO3)2 + Ca(OH)2 → ¿?
El hidróxido de calcio no es muy soluble en agua; pero la adición del nitrato de cobre ayuda a solubilizarlo porque reacciona para formar su hidróxido correspondiente:
Cu(NO3)2(ac) + Ca(OH)2(ac) → Cu(OH)2(s) + Ca(NO3)2(ac)
El Cu(OH)2 se reconoce al instante por ser un precipitado de color azul.
¿Qué sal se producirá en la siguiente reacción de neutralización?
Al(OH)3(s) + 3HCl(ac) → ¿?
El hidróxido de aluminio se comporta como una base reaccionando con el ácido clorhídrico. En una reacción de neutralización ácido-base (de Bronsted-Lowry) siempre se forma agua, por lo que el otro producto debe ser cloruro de aluminio, AlCl3:
Al(OH)3(s) + 3HCl(ac) → AlCl3(ac) + 3H2O
Esta vez el AlCl3 no precipita porque es una sal (hasta cierto punto) soluble en agua.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Ana Zita. (18 de noviembre de 2019). Reacciones químicas. Recuperado de: todamateria.com
- Kashyap Vyas. (23 de enero de 2018). 19 Cool Chemical Reactions that Prove Science is Fascinating. Recuperado de: interestingengineering.com
- BeautifulChemistry.net (s.f.). Reaction. Recuperado de: beautifulchemistry.net
- Wikipedia. (2019). Chemical reaction. Recuperado de: en.wikipedia.org
