Cloruro de hierro (III): estructura, propiedades, obtención, usos
El cloruro de hierro (III) es un compuesto inorgánico formado por los elementos hierro (Fe) y cloro (Cl). Su fórmula química es FeCl3. Es un sólido cristalino cuyo color puede ser desde anaranjado hasta marrón negruzco.
El FeCl3 se disuelve fácilmente en agua formando soluciones acuosas ácidas en las cuales al aumentar el pH haciéndolas más alcalinas puede formarse un sólido de óxido férrico.

El cloruro de hierro (III) se usa para sedimentar las partículas que contaminan el agua de residuos municipales o industriales. Se dice que permite remover algunos parásitos y sirve para detener pérdidas de sangre de heridas en animales y para la cicatrización de estas.
Sirve para extraer cobre (II) de minerales de sulfuro de cobre. También se emplea en diversas reacciones químicas y análisis de laboratorios biológicos y químicos. Por ejemplo, sirve para detectar compuestos como fenoles en aceites extraídos de plantas. Se utiliza en circuitos electrónicos, en el curtido de cuero y en fotografía.
Por ser el FeCl3 un compuesto ácido resulta corrosivo para piel y mucosas. Debe evitarse respirar el polvo de este compuesto. No se debe desechar al ambiente.
Índice del artículo
El cloruro de hierro (III) o cloruro férrico FeCl3 es un compuesto iónico y está formado por un ion férrico Fe3+ y tres iones cloruro Cl–. El hierro está en su estado de oxidación de +3 y cada cloro posee valencia -1.
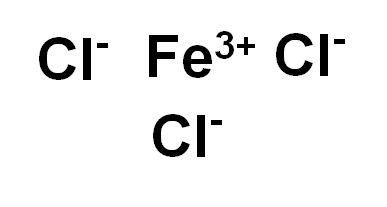
- Cloruro de hierro (III)
- Cloruro férrico
- Tricloruro de hierro
- Muriato de hierro
Sólido cristalino color naranja a marrón negruzco.

Anhidro FeCl3 = 162,2 g/mol
Anhidro FeCl3 = 304 ºC
Hexahidrato FeCl3•6H2O = 37 °C
Anhidro FeCl3 = Aproximadamente 316 ºC
Hexahidrato FeCl3•6H2O = 280-285 °C
Anhidro FeCl3 = 2,90 g/cm3 a 25 °C
Muy soluble en agua: 74,4 g/100 g de agua a 0 °C; 535,7 g/100 g de agua a 100 °C. Muy soluble en acetona, etanol, éter y metanol. Débilmente soluble en solventes no polares como benceno y hexano.
Sus soluciones acuosas son muy ácidas. Una solución de 0,1 moles de FeCl3 por litro de agua tiene un pH de 2,0.
Cuando se disuelve en agua el FeCl3 se hidroliza; es decir, se separa en sus iones Fe3+ y 3 Cl–. El Fe3+ forma el ion hexaacuohierro [Fe(H2O)6]3+ pero este se combina con los iones OH– del agua formando especies mixtas y liberando protones H+.
Por esta razón sus soluciones son ácidas. Si se va aumentando el pH, estas especies forman un gel y por último se forma un precipitado o sólido de óxido férrico hidratado Fe2O3•nH2O.
Los cristales de cloruro de hierro (III) son higroscópicos, esto es, absorben agua del ambiente. Cuando está húmedo es corrosivo para el aluminio y muchos metales.

Las soluciones acuosas de FeCl3 son muy ácidas y corrosivas para la mayoría de los metales. Poseen un débil olor a ácido clorhídrico HCl. Cuando se calienta hasta su descomposición el FeCl3 emite gases altamente tóxicos de HCl.
El cloruro de hierro (III) se produce por cloración directa del hierro haciendo reaccionar cloro seco (Cl2) con chatarra de hierro (Fe) a 500-700 °C.
La reacción se lleva a cabo en un reactor resistente a los ácidos. El primer paso es fundir a 600 °C una mezcla de cloruro de hierro (III) (FeCl3) y cloruro de potasio (KCl).

Luego se disuelve la chatarra de hierro (Fe) en dicha mezcla fundida en donde el hierro reacciona con el FeCl3 y se convierte en cloruro ferroso (FeCl2).
Fe + 2 FeCl3 → 3 FeCl2
Luego el FeCl2 reacciona con el cloro Cl2 formando el FeCl3 el cual sublima (pasa del estado sólido al gaseoso directamente) y se recoge en cámaras especiales de condensación.
2 FeCl2 + Cl2 → 2 FeCl3
También se puede hacer reaccionar el sulfato ferroso FeSO4 con cloro Cl2.
El hexahidrato FeCl3•6H2O se puede obtener mediante evaporación de una solución acuosa de iones Fe3+ y Cl– en un baño de vapor.
El cloruro férrico o cloruro de hierro (III) se encuentra en la naturaleza en forma del mineral molysita, el cual se encuentra en la lava de las fumarolas de volcanes activos. Entre los volcanes donde se puede encontrar está el Monte Vesubio.

El cloruro férrico se emplea para tratar aguas residuales municipales o industriales mediante sedimentación química.
Actúa como coagulante favoreciendo la unión de varias partículas entre sí, de esta forma se forman conglomerados o partículas más grandes que tienden a flocular o sedimentar (bajar por su propio peso al fondo del agua que se está tratando).

De esta forma se favorece la separación de sólidos del agua y esta queda libre de materiales no deseados.
Este tipo de tratamientos puede facilitar la remoción de parásitos, tales como los protozoarios, los cuales son microorganismos formados por una sola célula, como por ejemplo las amibas, que causan enfermedades.
Por esta razón el FeCl3 se utiliza también para purificar agua.
El cloruro de hierro (III) se utiliza para curar heridas de animales.
Sirve como astringente local (puede retraer los tejidos y actuar como antiinflamatorio y cicatrizante) y hemostático (detiene hemorragias o pérdidas de sangre).
Se utiliza en polvos para detener pérdidas de sangre o cuando se han cortado los cuernos al ganado vacuno. También se usa en forma de solución para detener hemorragias cuando se cortan garras o se eliminan verrugas.

Se emplea también para tratar faringitis (inflamación de la faringe) o estomatitis (inflamación de la mucosa bucal) y para aumentar la hemoglobina de la sangre en algunas aves.
El cloruro de hierro (III) o cloruro férrico FeCl3 se usa para extraer cobre (II) del mineral de cobre que contenga sulfuros de dicho metal.
Es un método oxidativo que es adecuado para evitar la liberación del gas tóxico dióxido de azufre (SO2), pues en lugar de este se genera azufre (S). Se producen soluciones con altas concentraciones de FeCl2, FeCl3, CuCl2 y otros cloruros metálicos.
4 FeCl3 + Cu2S ⇔ 4 FeCl2 + 2 CuCl2 + S↓
Entre muchos de sus usos en química sirve para indicar la presencia del grupo –OH fenólico (es decir, grupo –OH unido a un anillo bencénico).
Se disuelve el compuesto a analizar en etanol y se añaden unas gotas de solución de FeCl3. Cuando el compuesto posee grupo –OH unido a un anillo bencénico (o sea, es un fenol) se forma una coloración verde azulada.
Esta prueba permite analizar la presencia de los fenoles en extractos de plantas.
Se usa además en ensayos para determinar la actividad antioxidante de ciertos aceites extraídos de vegetales.
Otra de sus aplicaciones es que permite preparar otros compuestos químicos. Puede actuar además como agente oxidante, clorante (aportar cloro) y condensante (para unir dos o más moléculas entre sí).
También sirve como catalizador o acelerador de reacciones de química orgánica.
El cloruro férrico se utiliza en circuitos electrónicos impresos. Por la coloración de sus diversas formas hidratadas sirve como pigmento y se emplea en el curtido de cuero.

Es desinfectante. Se emplea para tratar desórdenes de la piel y también se utiliza en fotografía.
El polvo de FeCl3 es irritante para los ojos, nariz y boca. Si se inhala puede causar tos o dificultad para respirar. Es un compuesto corrosivo, por lo que el contacto prolongado con la piel y con los ojos o mucosas puede causar enrojecimiento y quemaduras.
No es inflamable, pero al ser calentado a altas temperaturas produce gas de cloruro de hidrógeno HCl, el cual es tóxico y muy corrosivo.
El FeCl3 es dañino para los organismos acuáticos y terrestres. Si por accidente es desechado al ambiente debe neutralizarse su acidez con compuestos básicos.
- U.S. National Library of Medicine. (2019). Ferric chloride. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volume 19. Fourth Edition. John Wiley & Sons.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. Volume A22. VCH Verlagsgesellschaft mbH.
- Ngameni, B. et al. (2013). Flavonoids and Related Compounds from the Medicinal Plants of Africa. Characterization of Flavonoids in Plant Extracts. Ferric Chloride Test. In Medicinal Plant Research in Africa. Recuperado de sciencedirect.com.
- Agyare, C. et al. (2017). Petroselinum crispum: a Review. Antioxidant activity. In medicinal Spices and Vegetables from Africa. Recuperado de sciencedirect.com.
- Stott, R. (2003). Fate and behavior of parasites in wastewater treatment systems. Chemically assisted sedimentation. In Handbook of Water and Wastewater Microbiology. Recuperado de sciencedirect.com.
- Tasker, P.A. et al. (2003). Applications of Coordination Chemistry. Extraction of CuII from chloride solutions. In Comprehensive Coordination Chemistry. Recuperado de sciencedirect.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
