Globina: características, estructura, función y alteraciones
La globina es una estructura de naturaleza proteica dispuesta en forma esférica o globular, siendo así de donde proviene su nombre. Esta estructura es de tipo terciaria y se caracteriza por ser compleja, ya que la cadena de aminoácidos se pliega hasta formar la esferoproteína. Existen varios tipos de cadenas de globina y estas fueron clasificadas en letras griegas: globina de cadena alfa, beta, delta, gamma, épsilon y zeta.
Los aminoácidos que conforman la estructura primaria de la proteína varían de acuerdo a la especie a la que pertenecen (humanos o animales). También existen variaciones dentro de una misma especie de acuerdo al estado de vida actual del organismo (vida embrionaria, vida fetal o vida post nacimiento).
La información genética para la síntesis de las diversas cadenas de globinas están contenidos en diversos cromosomas. Por ejemplo, las globinas de cadena alfa se encuentran en el cromosoma 16, mientras que la información genética de las globinas beta, delta, gamma y épsilon están en el cromosoma 11.
Índice del artículo
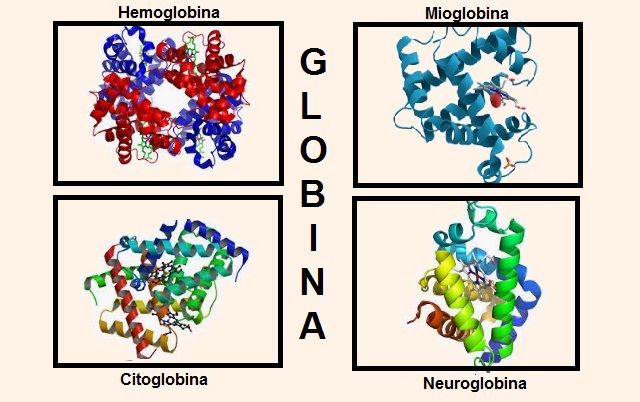
La globina forma parte de importantes estructuras en el organismo, por ejemplo las más relevantes son: la hemoglobina y la mioglobina.
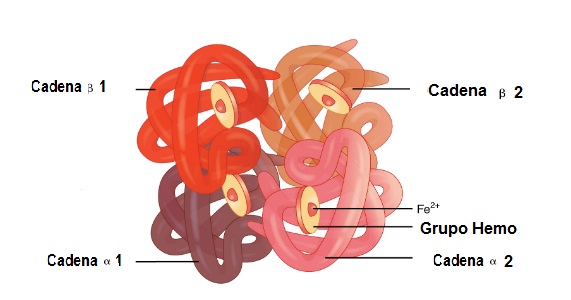
La hemoglobina contiene cuatro cadenas de globina (alfa 1 y alfa 2) y (beta 1 y beta 2). Cada globina posee un repliegue donde resguarda al grupo hemo.
Por otra parte, se encuentra la mioglobina. La cual tiene una estructura menos compleja que la hemoglobina. Esta presenta un polipéptido globular de una sola tira dispuesta de forma secundaria.
Hasta hace poco tiempo se creía que estas eran las únicas sustancias que contenían globina en los seres superiores, pero hoy día se conocen dos más que poseen globina en su constitución: la citoglobina y la neuroglobina.
La citoglobina está presente en la mayoría de los tejidos y especialmente se ubica en el tejido conectivo, así como también se ha encontrado en la retina.
A su vez, la neuroglobina tiene preferencia por el tejido nervioso, de allí su nombre. Se ha encontrado neuroglobina en células nerviosas del cerebro ubicadas a nivel de la corteza cerebral, así como en otras localizaciones como el tálamo, el hipotálamo, el hipocampo y el cerebelo.
Sin embargo, no son las únicas localizaciones, pues fuera del sistema nervioso se puede encontrar en los islotes de Langerhans del páncreas y en la retina.
Existen 6 tipos distintos de cadenas de globinas que se designan con las letras del alfabeto griego: alfa (α), beta (β), gamma (γ), delta (δ), épsilon (ε) y zeta (ζ). Estas cadenas pertenecen a la familia de las globinas, pero se diferencian entre sí en el número de aminoácidos que poseen.
Estos polipéptidos presentan una estructura primaria, secundaria y terciaria. La cadena simple de aminoácidos representa la estructura primaria. Cuando la cadena se enrolla formando espirales o hélices conforman la estructura secundaria.
Si esta estructura luego se pliega muchas veces sobre sí misma, forma una estructura globular correspondiente a la estructura terciaria.
Así mismo, solo pueden adquirir la forma cuaternaria cuando se combinan 4 moléculas o cadenas de globina en forma terciaria.
Así se presenta en la estructura compleja de la hemoglobina. Sin embargo, en la mioglobina es diferente. En este caso la globina se presenta como un monómero, es decir, posee una sola cadena peptídica que se dispone en pliegues, creando 8 hélices (estructura secundaria).
Tanto la hemoglobina como la mioglobina albergan en el interior de su compleja estructura un grupo hemo.
En esta molécula se unen 2 cadenas de globina alfa y 2 cadenas beta. Es así como quedan perfectamente acopladas para alojar en su centro al grupo hemo, más el hierro.
Entre estas estructuras existen uniones débiles y uniones fuertes. En las uniones débiles participan 19 aminoácidos y la unión se da de la siguiente manera: la cadena alfa 1 se une a la cadena beta 2 y la cadena alfa 2 se une a la cadena beta 1.
En tanto que, en las uniones fuertes participan 35 aminoácidos y las cadenas que se unen son: la cadena alfa 1 se une a la cadena beta 1 y la cadena alfa 2 se une a la cadena beta 2.
En la mioglobina también está presente un grupo proteico globular, pero en este caso hay una sola cadena peptídica constituida por 153 aminoácidos. Su disposición espacial es secundaria y presenta 8 hélices alfa.
Esta estructura proteica ubica de manera estratégica los aminoácidos hidrofóbicos hacia el interior de la estructura, en tanto que los aminoácidos hidrofílicos o polares se encuentran hacia el exterior.
Este diseño es perfecto para albergar al grupo hemo en su interior (parte hidrofóbica). Este se une a la proteína por enlaces no covalentes.
Fue descubierta en el año 2001 y se dice que es un tipo de hemoglobina, pero se diferencia en que es hexacoordinada, mientras que la hemoglobina y la mioglobina son pentacoordinadas. Esto tiene que ver con la posición que adopta el aminoácido histidina cercano al grupo hemo.
Su descubrimiento se realizó en el año 2000. La neuroglobina es un monómero que posee 150 aminoácidos, por tanto es muy similar a la mioglobina. La estructura de la neuroglobina presenta una similitud entre 21 a 25% con la mioglobina y la hemoglobina.
Debido a que la globina no se encuentra sola en el organismo, sino formando parte de ciertas estructuras, se mencionan las funciones que cumplen cada una de ellas:
Se encuentra en el interior de los eritrocitos. Se encarga de fijar y transportar el oxígeno desde los pulmones hacia los tejidos. Así como también depura el organismo del dióxido de carbono, haciendo el recorrido contrario.
El grupo hemo ubicado en la globina tiene como función almacenar moléculas de oxígeno para oxigenar el músculo cardíaco y el músculo esquelético.
Esta proteína se cree que pueda influir en la protección de los estados de hipoxia y estrés oxidativo en los tejidos. También se piensa que pueda transportar oxígeno arterial hasta el cerebro.
Se piensa que la neuroglobina tiene capacidad para fijar oxígeno, monóxido de carbono y óxido nítrico.
Sin embargo, aún no se sabe con certeza cuál es la función de la neuroglobina, pero se cree que esté relacionada con la regulación de la hipoxia e isquemia cerebral. Especialmente actuaría como un neuroprotector.
Debido a que la neuroglobina tiene una estructura similar a la hemoglobina y a la mioglobina, se especula que podría participar en el suministro de oxígeno a nivel neuronal. También se cree que pueda eliminar a los radicales libres y al nitrógeno que se producen en la cadena respiratoria.
En relación al óxido nítrico, se piensa que lo elimina cuando el oxígeno es normal y lo produce en procesos de hipoxia a partir del NO2.
Las cadenas alfa y beta de la globina son codificadas por genes diferentes ubicados en los cromosomas 16 y 11 respectivamente.
Los individuos que poseen hemoglobina S (anemia falciforme o drepanocítica) presentan un defecto en la cadena beta de la globina. El defecto consiste en una sustitución de bases nitrogenadas a nivel del nucleótido número 20 del gen involucrado, donde hay un cambio de adenina por una timina.
Las mutaciones en el gen βs del cromosoma 11 origina distintos haplotipos de globinas denominados: Senegal, Camerún, Benín, Bantú o CAR y Asiático o Árabe-Indio.
Conocer el tipo de haplotipo que presentan los pacientes con anemia falciforme tiene importancia epidemiológica, ya que permite conocer la distribución de los distintos haplotipos, pero además esta información aporta datos importantes para conocer el pronóstico de la enfermedad.
Por ejemplo: se sabe que el haplotipo Bantú es más grave, mientras que el tipo Senegal y asiático son más leves.
Las diferencias entre un haplotipo y otro radican en la cantidad de hemoglobina F que poseen. A mayor porcentaje de hemoglobina F y menor hemoglobina S mejor pronóstico. A menor cantidad de hemoglobina F y mayor cantidad de hemoglobina S peor pronóstico.
Estas mutaciones se heredan de forma autosómica junto con la mutación de la hemoglobina S.
- “Globina.” Wikipedia, La enciclopedia libre. 19 oct 2018, 13:44 UTC. 11 jul 2019, 17:26, wikipedia.org
- “Mioglobina.” Wikipedia, La enciclopedia libre. 7 jul 2019, 21:16 UTC. 11 jul 2019, 20:42, wikipedia.org
- Durán C, Morales O, Echeverri S, Isaza M. Haplotipos del gen de la globina beta en portadores de hemoglobina S en Colombia. Biomédica 2012; 32:103-111. Disponible en: scielo.org
- Forrellat M, Hernández P. Neuroglobina: nuevo miembro de la familia de las globinas. Rev Cubana Hematol Inmunol Hemoter 2011; 27 (3):291-296. Disponible en: scielo.sld
- “Citoglobina.” Wikipedia, La enciclopedia libre. 1 sep 2017, 17:26 UTC. 12 jul 2019, 00:28 wikipedia.org
