Calor cedido: fórmulas, cómo calcularlo y ejercicios resueltos
El calor cedido es la transferencia de energía entre dos cuerpos a distintas temperaturas. El que se encuentra mayor temperatura cede calor a aquel cuya temperatura es menor. Ya sea que un cuerpo ceda o absorba calor, su temperatura o su estado físico pueden variar en función de la masa y las características propias del material del que está hecho.
Un buen ejemplo se tiene en una taza de café humeante. La cucharilla de metal con la que se revuelve el azúcar se calienta. Si se la deja dentro de la taza el tiempo suficiente, café y cucharilla metálica terminarán por igualar sus temperaturas: el café se habrá enfriado y habrá cedido calor a la cucharilla. Algo de calor habrá pasado al ambiente, puesto que el sistema no está aislado.

Al igualarse las temperaturas se ha llegado al equilibrio térmico.
Si se hiciera la misma prueba con una cucharilla de plástico, seguramente notaría que esta no se calienta tan rápido como la de metal, pero eventualmente también llegará a estar en equilibrio con el café y todo lo que la rodea.
Esto se debe a que el metal conduce mejor el calor que el plástico. Por otra parte seguramente el café cede calor a una tasa diferente que el chocolate caliente u otra bebida. Entonces, el calor cedido o absorbido por cada objeto depende de qué material o sustancia esté hecho.
Índice del artículo
El calor siempre se refiere al flujo o tránsito de energía entre un objeto y otro, debido a la diferencia de temperatura.
Por eso se habla de calor cedido o de calor absorbido, ya que al agregar o extraer calor o energía de alguna manera, es posible modificar la temperatura de un elemento.
Normalmente se llama Q a la cantidad de calor que el objeto más caliente cede. Este valor es proporcional a la masa de dicho objeto. Un cuerpo con gran masa es capaz de ceder más calor que otro de menor masa.
Otro factor importante en el cálculo del calor cedido es la diferencia de temperatura que experimenta el objeto que cede el calor. Se la denota como ΔT y se calcula así:
ΔT= Tf – To
Finalmente, la cantidad de calor cedido también depende de la naturaleza y características del objeto, las cuales se resumen cuantitativamente en una constante llamada calor específico del material, denotada como c.
Así que finalmente la expresión para el calor cedido es la siguiente:
Qcedido = – m.c.ΔT
El hecho de ceder se simboliza con un signo negativo.
El calor específico es la cantidad de calor necesaria para elevar en 1 ºC la temperatura de 1 g de sustancia. Es una propiedad intrínseca del material. Sus unidades en Sistema Internacional son: Joule/kg . K (Joule entre kilogramo x temperatura en grados Kelvin).
La capacidad calorífica C es un concepto vinculado, pero ligeramente diferente, pues la masa del objeto interviene. Se define la capacidad calorífica de la siguiente manera:
C= mc
Sus unidades en S.I. son Joule/K. De manera que el calor cedido también puede expresarse equivalentemente como:
Q = -C. ΔT
Para calcular el calor cedido por un objeto se requiere conocer lo siguiente:
– El calor específico de la sustancia que cede el calor.
– La masa de dicha sustancia
– La temperatura final a obtener
Los valores del calor específico para muchos materiales se han determinado experimentalmente y están disponibles en tablas.
Ahora bien, si no se conoce este valor, es posible obtenerlo con ayuda de un termómetro y agua en un recipiente aislado térmicamente: el calorímetro. Un esquema de este dispositivo se muestra en la figura que acompaña al ejercicio 1.
Se sumerge una muestra de la sustancia a una cierta temperatura en una cantidad de agua que previamente se ha medido. Se mide la temperatura final y con los valores obtenidos se determina el calor específico del material.
Comparando el resultado con los valores tabulados, puede saberse de qué sustancia se trata. A este procedimiento se le denomina calorimetría.
El balance de calor se lleva a cabo mediante la conservación de la energía:
Q cedido + Q absorbido = 0
Se introduce una pieza de cobre de 0.35 kg a una temperatura de 150 ºC en 500 mL de agua a una temperatura de 25 º C. Encontrar:
a) La temperatura final de equilibrio
b) ¿Cuánto calor fluye en este proceso?
Datos
ccobre =385 J/kg . ºC
cagua = 4180 J/kg . ºC
Densidad del agua: 1000 kg/m3
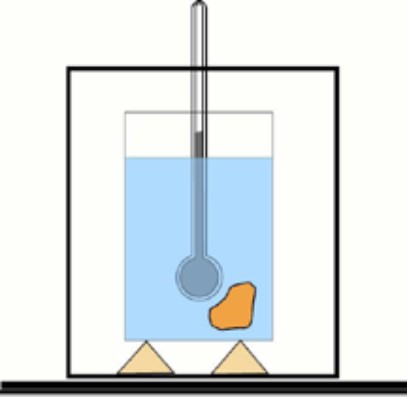
Solución
a) El cobre cede calor mientras que el agua lo absorbe. Como el sistema se considera cerrado, solamente el agua y la muestra intervienen en el balance de calor:
Q cedido = Q absorbido
Por otra parte, se requiere calcular la masa de 500 mL de agua:
500 mL = 0.5 L = 0.0005 m3
Con estos datos se calcula la masa del agua:
masa = densidad x volumen = 1000 kg/m3 . 0.0005 m3 = 0.5 kg
Se plantea la ecuación para el calor en cada sus sustancia:
Qcedido = -mcobre . ccobre. ΔT =-0.35 kg . 385 J/kg .ºC . (Tf –150 ºC) =-134.75 (Tf – 150) J
Qabsorbido =magua . cagua. ΔT = 0.5 kg . 4186 J/kg . ºC .(Tf –25 ºC) = 2093 (Tf –25) J
Igualando los resultados se tiene:
2093 (Tf – 25) = -134.75 (Tf – 150)
Es una ecuación lineal con una incógnita, cuya solución es:
Tf = 32.56 ºC
b) La cantidad de calor que fluye es el calor cedido o bien el calor absorbido:
Q cedido = – 134.75 (32.56 – 150) J = 15823 J
Q absorbido = 2093 (32.56 – 25) J = 15823 J
Un trozo de cobre de 100 g se calienta en un horno a una temperatura To y luego se introduce en un calorímetro de cobre de 150 g que contiene 200 g de agua a 16 º C. La temperatura final una vez en equilibrio es de 38 º C. Cuando se pesan el calorímetro y su contenido, se encuentra que se han evaporado 1.2 g de agua ¿Cuál era la temperatura inicial To?
Datos: el calor latente de vaporización de agua es Lv = 2257 kJ/kg
Solución
Este ejercicio difiere del anterior, ya que hay que considerar que el calorímetro también absorbe calor. El calor cedido por el trozo de cobre se invierte en todo lo siguiente:
– Calentar el agua del calorímetro (200 g)
– Calentar el cobre del que está hecho el calorímetro (150 g)
– Evaporar 1.2 gramos de agua (para un cambio de fase también se necesita energía).
Qcedido = –100 x 1 x 10 -3 kg. 385 J/kg . ºC. (38 – To )ºC = –38.5. (38 – To)J
Q absorbido por elcalorímetro = Q absorbido por el agua + Q vaporización + Q absorbido por el cobre
0.2 kg .4186 J/kg ºC .(38 – 16 ºC) + 1.2 x 10-3 kg. 2257000 J/kg +0.150 kg .385 J/kg .ºC.(38 – 16 ºC) =
18418.4 +2708.4 + 1270.5 J = 22397.3 J
Por lo tanto:
–38.5. (38 – To)= 22397.3
To = 619.7 ºC
Pudo haberse considerado también el calor necesario para llevar el 1.2 g de agua hasta 100 º C, pero es una cantidad bastante pequeña en comparación.
- Giancoli, D. 2006. Physics: Principles with Applications. 6th. Ed. Prentice Hall. 400 – 410.
- Kirkpatrick, L. 2007. Física: Una mirada al mundo. 6ta Edición abreviada. Cengage Learning. 156 – 164.
- Rex, A. 2011. Fundamentos de Física. Pearson. 309 – 332.
- Sears, Zemansky. 2016. University Physics with Modern Physics. 14th. Ed. Volume 1. 556 – 553.
- Serway, R., Vulle, C. 2011. Fundamentos de Física. 9na Cengage Learning.
