Cianuro de potasio (KCN): propiedades, usos, estructuras, riesgos,
El cianuro de potasio es un compuesto inorgánico formado por un ion potasio K+ y un ion cianuro CN–. Su fórmula química es KCN. Es un sólido blanco cristalino, extremadamente venenoso.
El KCN es muy soluble en agua y al disolverse se hidroliza formando ácido cianhídrico o cianuro de hidrógeno HCN, el cual también es muy venenoso. El cianuro de potasio puede formar sales compuestas con el oro y la plata por lo que antiguamente se utilizaba para extraer estos metales preciosos de ciertos minerales.

El KCN se emplea para recubrir metales baratos con oro y plata mediante un proceso electroquímico, esto es, un método en el que se hace pasar una corriente eléctrica por una solución que contiene una sal compuesta por el metal precioso, cianuro y potasio.
El cianuro de potasio debido a que contiene cianuro debe ser manipulado con mucha precaución, con implementos adecuados. Nunca debe ser desechado al ambiente, porque es muy tóxico también para la mayoría de animales y plantas.
Sin embargo, se están estudiando métodos que utilizan algas comunes para remover cianuro de potasio de aguas contaminadas con bajas concentraciones de este.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Uso en la electrodeposición de metales
- 6 Riesgos
- 7 Mecanismo de acción
- 8 Estudios recientes
- 9 Referencias
El KCN es un compuesto iónico formado por un catión potasio K+ y un anión cianuro CN–. En este el átomo de carbono está unido al átomo de nitrógeno mediante un enlace covalente triple.
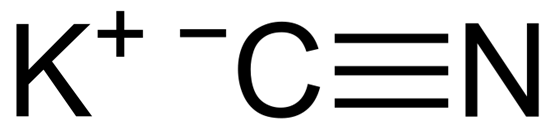
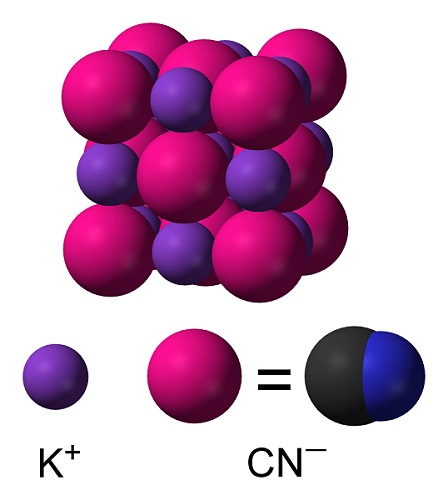
En el cianuro de potasio sólido el anión CN– puede rotar libremente por lo que se comporta como un anión esférico, como consecuencia el cristal de KCN posee una estructura cúbica similar a la del cloruro de potasio KCl.
– Cianuro de potasio
– Cianuro potásico
– Cianopotasio
Sólido cristalino blanco. Cristales cúbicos.
65,116 g/mol.
634,5 °C
1625 °C.
1,55 g/cm3 a 20 °C.
Muy soluble en agua: 716 g/L a 25 °C y 100 g/100 mL de agua a 80 °C. Poco soluble en metanol: 4,91 g/100 g de metanol a 19,5 °C. Muy poco soluble en etanol: 0,57 g/100 g de etanol a 19,5 °C.
Una solución acuosa de 6,5 g de KCN en 1 L de agua tiene un pH de 11,0.
El KCN es muy soluble en agua. Al disolverse queda libre el ion cianuro CN– el cual toma un protón H+ del agua para formar ácido cianhídrico HCN y liberando un ion OH–:
CN– + H2O → HCN + OH–
La constante de hidrólisis indica la tendencia con la que se realiza dicha reacción.
Kh = 2,54 x 10-5
Las soluciones acuosas de KCN liberan al ambiente cianuro de hidrógeno HCN cuando se calientan por encima de 80 °C.
No es inflamable, pero cuando se calienta el KCN sólido hasta su descomposición emite gases muy tóxicos de cianuro de hidrógeno HCN, óxidos de nitrógeno NOx, óxido de potasio K2O y monóxido de carbono CO.
El KCN reacciona con sales de oro formando aurocianuro de potasio KAu(CN)2 y auricianuro de potasio KAu(CN)4. Estas son sales complejas incoloras. Con el metal plata Ag, el KCN forma el argentocianuro potásico KAg(CN)2.
El ion cianuro del KCN reacciona con ciertos compuestos orgánicos que poseen halógenos (como cloro o bromo) y ocupa el lugar de estos. Por ejemplo, reacciona con el ácido bromoacético para dar ácido cianoacético.
Es higroscópico, absorbe humedad del ambiente.
Posee un suave olor a almendras amargas, pero este no es detectado por todas las personas.
El KCN se prepara mediante la reacción de hidróxido de potasio KOH en solución acuosa con cianuro de hidrógeno HCN. También se obtiene calentando el ferrocianuro potásico K4Fe(CN)6:
K4Fe(CN)6 → 4 KCN + 2 C + N2↑ + Fe
Se usa en el proceso de recubrir metales poco valiosos con oro y plata. Es un proceso electrolítico, es decir, se hace pasar electricidad por una solución acuosa con sales apropiadas.
Se utiliza el argentocianuro de potasio KAg(CN)2 para recubrir con plata (Ag) metales más baratos.
Estos se colocan en una solución acuosa de argentocianuro potásico KAg(CN)2, donde el ánodo o polo positivo es una barra de plata pura (Ag) y el cátodo o polo negativo es el metal barato que se quiere recubrir de plata.
Al pasar una corriente eléctrica por la solución, la plata se deposita sobre el otro metal. Cuando se utilizan sales de cianuro la capa de plata se deposita de una manera más fina, compacta y adherente que en soluciones de otros compuestos.

De forma similar en el caso del oro (Au), el aurocianuro de potasio KAu(CN)2 y auricianuro de potasio KAu(CN)4 se utilizan para dorar electrolíticamente otros metales.

A continuación se mencionan algunos otros usos del cianuro potásico.
– Para el proceso industrial de endurecimiento del acero por nitruración (adición de nitrógeno).
– Para la limpieza de metales.
– En procesos de impresión y fotografía.
– Antiguamente se usaba para la extracción de oro y plata de los minerales que los contienen, pero luego fue sustituido por el cianuro de sodio NaCN que es menos costoso, aunque igualmente tóxico.
– Como insecticida para la fumigación de árboles, barcos, vagones de ferrocarril y almacenes.
– Como reactivo en química analítica, esto es, para hacer análisis químicos.
– Para preparar otros compuestos químicos, como colorantes y tintes.

El KCN es un compuesto muy venenoso para los animales y la mayoría de plantas y microorganismos. Está clasificado como súper tóxico. Es letal aún en muy pequeñas cantidades.
Su efecto dañino puede ocurrir por inhalación, contacto con la piel u ojos, o ingestión. Inhibe muchos procesos metabólicos, especialmente de las proteínas de la sangre que participan en el transporte de oxígeno como la hemoglobina.
Afecta los órganos o sistemas más sensibles a la falta de oxígeno, como el sistema nervioso central (cerebro), el sistema cardiovascular (corazón y vasos sanguíneos) y los pulmones.

El KCN interfiere con la habilidad del organismo de utilizar el oxígeno.
El ion cianuro CN– del KCN posee una gran afinidad por el ion férrico Fe3+, lo que significa que cuando se absorbe cianuro este reacciona rápidamente con el Fe3+ de la sangre y tejidos.
De esta forma impide la respiración de las células, las cuales entran en un estado de falta de oxígeno, pues aunque intentan respirar no lo pueden utilizar.
Ocurre entonces un estado transitorio de hiperapnea (suspensión de la respiración) y dolor de cabeza, y finalmente la muerte por paro respiratorio.
Al calentarlo produce gases muy tóxicos tales como HCN, óxidos de nitrógeno NOx, óxido de potasio K2O y monóxido de carbono CO.
Al entrar en contacto con humedad libera HCN el cual es altamente inflamable y muy tóxico.
El KCN es muy venenoso también para los organismos acuáticos. Nunca debe desecharse al ambiente, pues puede ocurrir contaminación de aguas donde beben animales y habitan peces.
Sin embargo, hay bacterias que producen cianuro como la Chromobacterium violaceum y algunas especies de Pseudomonas.
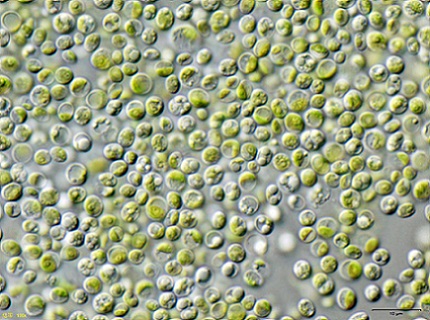
Ciertos investigadores encontraron que el alga verde Chlorella vulgaris puede utilizarse para tratar aguas contaminadas con cianuro de potasio KCN en bajas concentraciones.
El alga pudo remover de forma eficiente el KCN, pues este en bajas cantidades estimuló el crecimiento del alga ya que esta activó un mecanismo interno para resistir la toxicidad del KCN.
Esto significa que el alga Chlorella vulgaris tiene el potencial de remover cianuro y que se podría diseñar con esta un método efectivo para el tratamiento biológico de la contaminación con cianuro.
- U.S. National Library of Medicine. (2019). Potassium cyanide. National Center for Biotechnology Information. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Coppock, R.W. (2009). Threats to Wildlife by Chemical Warfare Agents. In Handbook of Toxicology of Chemical Warfare Agents. Recuperado de sciencedirect.com.
- Liu, Q. (2017). Evaluation of the Removal of Potassium Cyanide and its Toxicity in Green Algae (Chlorella vulgaris). Bull Environ Contam Toxicol. 2018; 100(2):228-233. Recuperado de ncbi.nlm.nih.gov.
- The National Institute for Occupational Safety and Health (NIOSH). (2011). Potassium Cyanide: Systemic Agent. Recuperado de cdc.gov.
- Alvarado, L.J. et al. (2014). Riboswitch Discovery, Structure and Function. Synthesis of Uracil. In Methods in Enzymology. Recuperado de sciencedirect.com.
