Halógenos: qué son, propiedades, estructura química, usos
¿Qué son los halógenos?
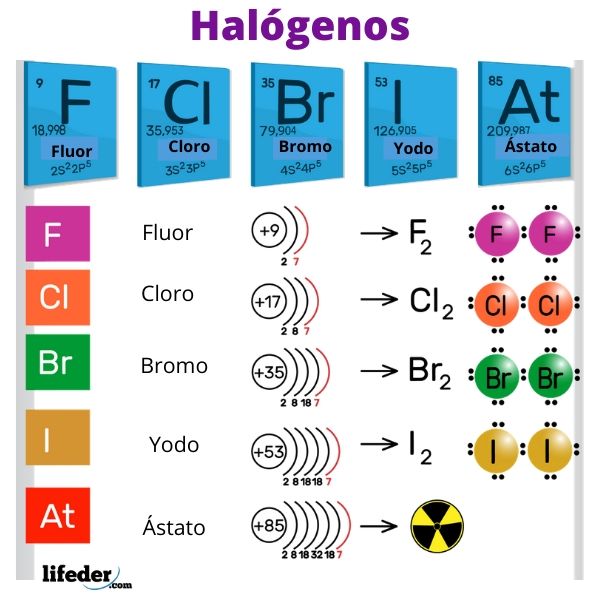
Los halógenos son elementos no metálicos que pertenecen al grupo VIIA o 17 de la tabla periódica. Poseen electronegatividades y afinidades electrónicas altas, las cuales repercuten enormemente en el carácter iónico de sus enlaces con los metales. La palabra ‘halógenos’ es de origen griego y significa “formadores de sales”.
Los halógenos son el flúor (F), el cloro (Cl), el bromo (Br), el yodo (I) y el elemento radiactivo y efímero ástato (At). Son tan reactivos que reaccionan entre ellos mismos para formar moléculas diatómicas: F2, Cl2, Br2, I2 y At2.
Estas moléculas se caracterizan por tener propiedades estructurales semejantes (moléculas lineales), aunque con diferentes estados físicos.
¿Cuál es la apariencia de los halógenos?
En la imagen inferior se muestran tres halógenos. De izquierda a derecha: cloro, bromo y yodo. Ni el flúor ni el ástato pueden guardarse dentro de recipientes de vidrio, ya que estos últimos no resisten su corrosividad. Nótese cómo cambian las propiedades organolépticas de los halógenos a medida que se desciende por su grupo hasta el elemento yodo.
El flúor es un gas de tonalidades amarillentas; el cloro también, pero amarillo-verdoso; el bromo es un líquido rojizo oscuro; el yodo, un sólido negro con visos violetas; y el astato, un sólido metálico oscuro y brillante.
Los halógenos son capaces de reaccionar con casi todos los elementos de la tabla periódica, incluso con algunos gases nobles (como el xenón y el kriptón). Cuando lo hacen, pueden oxidar los átomos a sus estados de oxidación más positivos, convirtiéndoles en potentes agentes oxidantes.
Asimismo, confieren propiedades específicas a las moléculas cuando se enlazan o sustituyen a algunos de sus átomos. Este tipo de compuestos recibe el nombre de haluros. De hecho, los haluros constituyen la fuente natural principal de los halógenos, y muchos de ellos están disueltos en el mar o forman parte de un mineral; tal es el caso de la fluorita (CaF2).
Tanto los halógenos como los haluros tienen una amplia gama de usos, desde industriales o tecnológicos, hasta el de simplemente resaltar el sabor de ciertos alimentos, como lo hace la sal gema (cloruro de sodio).
Propiedades físicas y químicas de los halógenos
Pesos atómicos
Flúor (F) 18,99 g/mol; Cloro (Cl) 35,45 g/mol; Bromo (Br) 79,90 g/mol; Iodo (I) 126,9 g/mol y Astato (At) 210 g/mol.
Estado físico
F gaseoso; Cl gaseoso; Br líquido; I sólido y At sólido.
Color
F, amarillo-marrón pálido; Cl, verde pálido; Br, rojizo-marrón; I, violeta y At, negro metálico* *(asumido)
Puntos de fusión
F -219,6º C; Cl -101,5º C; Br -7,3º C; I 113,7º C y At 302º C.
Puntos de ebullición
F -118,12º C; Cl -34,04º C; Br 58,8º C; I 184,3º C y ?At 337º C.
Densidad a 25º C
F- 0,0017 g/cm3; Cl- 0,0032 g/cm3; Br- 3,102 g/cm3; I- 4,93 g/cm3 y At- 6,2-6,5 g/cm3
Solubilidad en agua
Cl- 0,091 mmol/cm3; Br- 0,21 mmol/cm3 y I- 0,0013 mmol/cm3.
Energía de ionización
F- 1.681 kJ/mol; Cl- 1.251 kJ/mol; Br- 1,140 kJ/mol; I- 1,008 kJ/mol y At- 890 kJ/mol.
Electronegatividad
F- 4,0; Cl- 3,0; Br- 2,8; I- 2,5 y At- 2,2.
Los halógenos tienen 7 electrones en su capa de valencia, de allí su gran avidez para ganar un electrón. Asimismo, los halógenos tienen una electronegatividad alta debido a sus pequeños radios atómicos y a la gran atracción que ejerce el núcleo sobre los electrones de valencia.
Reactividad
Los halógenos son altamente reactivos, lo que explicaría entonces su toxicidad. Además, son agentes oxidantes.
El orden decreciente de reactividad es: F> Cl> Br> I> At.
Estado en la naturaleza
Debido a su gran reactividad, los átomos de halógenos no se encuentran libres en la naturaleza, sino que se hallan formando agregados o como moléculas diatómicas unidas por enlaces covalentes.
Estructuras moleculares
Los halógenos no existen en la naturaleza como átomos elementales, sino como moléculas diatómicas. Sin embargo, todas tienen en común una estructura molecular lineal, y la única diferencia reside en la longitud de sus enlaces y en sus interacciones intermoleculares.
Las moléculas lineales X-X (X2) se caracterizan por ser inestables, debido a que ambos átomos atraen fuertemente el par de electrones hacia ellos. ¿Por qué? Porque sus electrones externos experimentan una carga nuclear efectiva muy alta, Zef. A mayor Zef, menor será la distancia del enlace X-X.
A medida que se desciende por el grupo, Zef se hace más débil y la estabilidad de dichas moléculas se incrementa. Así, el orden decreciente de reactividad es: F2>Cl2>Br2>I2. Sin embargo, resulta incongruente comparar el ástato con el flúor, ya que se le desconocen isótopos lo suficientemente estables a raíz de su radiactividad.
Interacciones intermoleculares
Por otro lado, sus moléculas carecen de momento dipolar, siendo apolares. Este hecho es responsable de sus débiles interacciones intermoleculares, cuya única fuerza latente es la de dispersión o de London, la cual es proporcional a la masa atómica y al área molecular.
De esta manera, la molécula pequeña de F2 no posee la suficiente masa ni los electrones para formar un sólido. A diferencia de I2, la molécula de yodo, que sin embargo continúa siendo un sólido que desprende vapores morados.
El bromo representa un ejemplo intermedio entre ambos extremos: las moléculas de Br2 interactúan lo suficiente para presentarse en estado líquido.
El ástato, probablemente debido a su creciente carácter metálico, no se presenta como At2 sino como átomos de At formando enlaces metálicos.
Respecto a sus colores (amarillo-amarillo verdoso-rojo-morado-negro), la explicación más apropiada se fundamenta en la teoría del orbital molecular (TOM). La distancia energética entre el último orbital molecular lleno, y el siguiente de mayor energía (de antienlace), se supera mediante la absorción de un fotón con longitudes de onda cada vez más grandes.
Haluros
Los halógenos reaccionan para formar haluros, ya sean inorgánicos u orgánicos. Los más conocidos son los haluros de hidrógeno: fluoruro de hidrógeno (HF), cloruro de hidrógeno (HCl), bromuro de hidrógeno (HBr) y yoduro de hidrógeno (HI).
Todos ellos disueltos en agua generan soluciones ácidas; tan ácidas, que el HF puede degradar cualquier recipiente de vidrio. Además, se consideran materiales de partida para la síntesis de ácidos extremedamente fuertes.
También existen los llamados haluros metálicos, los cuales tienen fórmulas químicas que dependen de la valencia del metal. Por ejemplo, los haluros de los metales alcalinos tienen por fórmula MX, y entre ellos están: NaCl, cloruro de sodio; KBr, bromuro de potasio; CsF, fluoruro de cesio; y LiI, yoduro de litio.
Los haluros de los metales alcalinotérreos, metales de transición o metales del bloque p, tienen por fórmula MXn, siendo n la carga positiva del metal. Así, algunos ejemplos de ellos son: FeCl3, tricloruro férrico; MgBr2, bromuro de magnesio; AlF3, trifluoruro de aluminio; y CuI2, yoduro cúprico.
Sin embargo, los halógenos también pueden formar enlaces con los átomos de carbono; por lo tanto, pueden inmiscuirse en el complejo mundo de la química orgánica y el de la bioquímica. Estos compuestos se denominan haluros orgánicos, y tiene por fórmula química general RX, siendo X cualquiera de los halógenos.
Usos/aplicaciones de los halógenos
Cloro
En la industria
-El bromo y el cloro se utilizan en la industria textil para blanquear y tratar la lana, evitando así su encogimiento al mojarse.
-Se usa como desinfectante de ditritus y para la purificación del agua potable y las piscinas. Además, compuestos derivados del cloro son utilizados en las lavanderías y en la industria papelera.
-Encuentra uso en la fabricación de pilas especiales e hidrocarburos clorados. También se usa en el procesamiento de las carnes, verduras, pescados y frutas. Asimismo, el cloro funciona como agente bactericida.
-Se usa para limpiar y destanificar el cuero, y para blanquear la celulosa. Antiguamente se utilizaba el tricloruro de nitrógeno como blanqueador y acondicionador de la harina.
-El gas fosfeno (COCl2) se utiliza en numerosos procesos de síntesis industriales, así como en la fabricación de gases militares. El fosfeno es muy tóxico y es responsable de numerosas muertes en la Primera Guerra Mundial, donde se utilizó el gas.
-Este gas también se encuentra en insecticidas y fumigantes.
-El NaCl es una sal muy abundante que se utiliza para sazonar los alimentos y en la conservación de carnes de ganado y aves. Además, se utiliza en los líquidos de rehidratación corporal, tanto en forma oral como intravenosa.
En la medicina
-Los átomos de halógenos que se unen a las drogas hacen que estas sean más lipofílicas. Esto permite que las drogas atraviesen más fácilmente las membranas celulares disolviéndose en los lípidos que la forman.
-El cloro se difunde hacia el interior de las neuronas del sistema nervioso central a través de canales iónicos unidos a los receptores del neurotransmisor GABA, produciendo así un efecto sedante. Este es el mecanismo de acción de varios ansiolíticos.
-El HCl se encuentra presente en el estómago, donde interviene creando un ambiente reductor que favorece el procesamiento de los alimentos. Además, el HCl activa la pepsina, enzima que inicia la hidrólisis de las proteínas, etapa previa a la absorción intestinal del material proteico.
Otros
-El ácido clorhídrico (HCl) se utiliza en la limpieza de los baños, en los laboratorios de docencia e investigación y en numerosas industrias.
-El PVC (cloruro de polivinilo) es un polímero de cloruro de vinilo que se utiliza en ropas, baldosas para pisos, cables eléctricos, tubos flexibles, tuberías, estructuras inflables y tejas para el techo. Además, el cloro es utilizado como intermediario en la elaboración de otros materiales plásticos.
-El cloro se usa en la extracción del bromo.
-El cloruro de metilo cumple una función de anestésico. También se utiliza en la elaboración de ciertos polímeros de silicona y en la extracción de grasas, aceites y resinas.
-El cloroformo (CHCl3) es un solvente empleado en muchos laboratorios, especialmente en los laboratorios de química orgánica y bioquímica, desde los de docencia, hasta los investigativos.
-Y finalmente, con respecto al cloro, el tricloroetileno se usa para desengrasar piezas de metal.
Bromo
-El bromo se emplea en el proceso de extracción minera del oro y en la perforación de pozos petroleros y de gas. Se usa como retardador de la combustión en las industrias del plástico y del gas. El bromo aísla el fuego del oxígeno causando que este se apague.
-Es un intermediario en la fabricación de fluidos hidráulicos, agentes refrigerantes y deshumidificadores y preparados para moldear el cabello. El bromuro potásico se emplea en la fabricación de placas y papeles fotográficos.
-El bromuro de potasio es utilizado también como anticonvulsivo, pero debido a la posibilidad de que la sal pueda provocar disfunciones neurológicas se ha disminuido su uso. Adicionalmente, otro de sus usos comunes es como pastilla para mediciones de muestras sólidas de espectroscopia de infrarrojo.
-Compuestos del bromo están presentes en medicamentos utilizados en el tratamiento de la neumonía. Asimismo, compuestos de bromo son incorporados a medicamentos utilizados en los ensayos que se realizan en el tratamiento de la enfermedad de Alzheimer.
-El bromo se emplea para reducir la contaminación con mercurio en las plantas eléctricas que usan como combustible el carbón. También se usa en la industria textil para crear diferentes tintes de color.
-El bromo metilo se usó como plaguicida para la fumigación del suelo y las viviendas, pero su efecto dañino sobre el ozono ha limitado su uso.
-Las lámparas de halógenos son incandescentes y el agregado de pequeñas cantidades de bromo y yodo permite una reducción en el tamaño de las bombillas.
Yodo
-El yodo interviene en el funcionamiento de la glándula tiroidea, hormona reguladora del metabolismo corporal. La glándula tiroidea secreta las hormonas T3 Y T4, las cuales ejercen su acción sobre sus órganos blanco. Por ejemplo, la acción hormonal sobre el músculo cardíaco provoca un aumento de la presión arterial y de la frecuencia cardíaca.
-Asimismo, el yodo se utiliza en la identificación de la presencia de almidón. El yoduro de plata es un reactivo empleado en la revelación de las fotografías.
Flúor
-Algunos compuestos de flúor se añaden a las pastas dentales con el fin de prevenir la aparición de caries. Derivados del flúor están presentes en varios anestésicos. En la industria farmacéutica incorporan flúor a los medicamentos para estudiar así posibles mejoras de sus efectos sobre el organismo.
-El ácido fluorhídrico se utiliza para grabar vidrios. También en la producción de halones (gases extinguidores de incendios, tales como el freón). Un compuesto de flúor se emplea en la electrólisis del aluminio para lograr así su purificación.
-Los revestimientos antirreflejantes contienen un compuesto del flúor. Este es utilizado en la fabricación de pantallas de plasma, pantallas planas y sistemas microelectromecánicos. El flúor está igualmente presente en la arcilla usada en algunas cerámicas.
Ástato
Se piensa que el ástato podría coadyuvar al yodo en la regulación del funcionamiento de la glándula tiroides. Asimismo, su isótopo radiactivo (210At) se ha usado en estudios de cáncer en ratones.
Referencias
- Enciclopedia de Salud y Seguridad en el Trabajo. Halógenos y sus compuestos. [PDF]. Tomado de:
- empleo.gob.es
- Chemistry LibreTexts. Group 17: General Properties of Halogens. Tomado de: chem.libretexts.org
- Wikipedia. (2018). Halogen. Tomado de: en.wikipedia.org
- Jim Clark. (Mayo de 2015). Atomic and Physical Properties of the Group 7 Elements (The Halogens). Tomado de: chemguide.co.uk
- Whitten, K. W., Davis, R. E., Peck, M. L. y Stanley, G. G. Chemistry (2003), 8th ed. Cengage Learning.
- Elementos. Halógenos. Tomado de: elementos.org.es
- Brown, Laurel. (24 de abril de 2017). Halogen Characteristics. Sciencing. Recuperado de: sciencing.com
