Actina: características, estructura, filamentos, función
La actina es una proteína citosólica que forma microfilamentos. En los eucariotas, la actina es una de las proteínas más abundantes. Por ejemplo, representa el 10% en peso de la proteína total en las células musculares; y entre 1 y 5% de la proteína en células no musculares.
Esta proteína, junto a los filamentos intermedios y los microtúbulos, forma el citoesqueleto, cuya función principal es la movilidad de la célula, el mantenimiento de la forma celular, la división celular y el movimiento de organelas en plantas, hongos y animales.
Las isoformas del citoesqueleto de actina tienen funciones diferentes, tales como: regulación en el desarrollo de la tensión activa en el músculo liso, ciclo celular, desarrollo de los embriones, desarrollo de tejidos y cicatrización de heridas.
Desde el punto de vista evolutivo, la actina es una proteína altamente conservada. Existe alrededor de 90% de homología de secuencia en diferentes especies. En organismos unicelulares, un único gen codifica una isoforma de actina. Mientras que en organismos multicelulares, diferentes genes codifican múltiples isoformas de actina.
La actina, junto con la miosina, fueron estructuras cruciales en el devenir evolutivo de los organismos eucariotas y en la diversificación de los mismos, ya que permitieron el movimiento en ausencia de otras estructuras, como flagelos y cilios.
Índice del artículo
- 1 Estructura: filamentos de actina
- 2 ¿Dónde encontramos a la actina?
- 3 Características
- 4 Funciones
- 5 Enfermedades relacionadas a la actina
- 6 Referencias
La actina es una proteína globular de una sola cadena polipeptídica. En el músculo, la actina tiene una masa molecular de aproximadamente unos 42 KDa.
Esta proteína posee dos dominios. Cada uno tiene dos subdominios, y una hendidura entre los dominios. El ATP–Mg+2 se une al fondo de la hendidura. Los amino y carboxilo terminales se juntan en el subdominio 1.
Hay dos formas de actina principales: el monómero de actina, denominado actina G; y un polímero filamentoso, conformado por monómeros de actina G, denominado actina F. Los filamentos de actina, observados mediante microscopia electrónica, tienen regiones angostas y anchas, de respectivamente 7 nm y 9 nm de diámetro.
A lo largo del filamento, los monómeros de actina forma una doble hélice apretujada. Una unidad que se repite a lo largo del filamento consta de 13 hélices y 28 monómeros de actina, y tiene una distancia de 72 nm.
El filamento de actina tiene dos extremos. Uno lo forma la hendidura que une ATP–Mg+2, que se sitúa en la misma dirección en todos los monómeros de actina del filamento, denominado extremo (–); y el otro extremo es el opuesto, denominado extremo (+). Por ello, se dice que el filamento de actina tiene polaridad.
Muchas veces estos componentes son conocidos como microfilamentos, ya que son los componentes del citoesqueleto que presentan menor diámetro.
La actina es una proteína extremadamente común en los organismos eucariotas. De todas las proteínas celulares, la actina representa cerca del 5 al 10% – dependiendo del tipo celular. En el hígado, por ejemplo, cada una de las células que lo constituyen posee casi 5.108 moléculas de actina.
Las dos formas de la actina, monómero y filamento, se encuentran continuamente en un equilibrio dinámico entre polimerización y despolimerización. En general, hay tres características resaltantes de este fenómeno:
1) Los filamentos de actina son típicos de la estructura del tejido muscular y del citoesqueleto de las células eucariotas.
2) La polimerización y despolimerización es un proceso dinámico que es regulado. Donde la polimerización o agregación de monómeros de actina G–ATP–Mg+2 sucede por ambos extremos. Que este proceso ocurra depende de las condiciones del medio y las proteínas reguladoras.
3) La formación de haces y retículos, que componen el citoesqueleto de actina, da fuerza a la motilidad celular. Esto depende de proteínas que participan en la formación de enlaces cruzados.
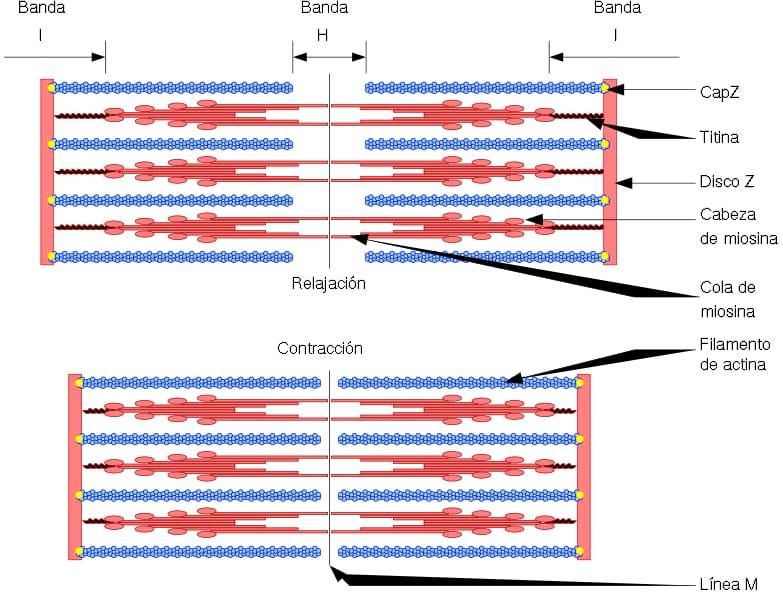
La unidad funcional y estructural del musculo esquelético es el sarcómero, el cual posee dos tipos de filamentos: los filamentos delgados, formados por actina, y los filamentos gruesos, formados por miosina. Ambos filamentos están organizados de forma alternada, de una manera geométrica precisa. Permiten la contracción muscular.
Los filamentos delgados están anclados a regiones denominadas discos Z. Esta región consiste en un entramado de fibras, en el que se encuentra la proteína CapZ, y a la cual se anclan los extremos (+) de los filamentos de actina. Este anclaje evita despolimerización del extremo (+).
Por otro lado, en los extremos (–) de los filamentos de actina se localiza la tropomodulina, y los protege de la despolimerización. Además de la actina, los filamentos delgados poseen tropomiosina y troponina, que tienen como función controlar las interacciones de actomiosina.
¿Cómo ocurre la contracción muscular?
Durante la contracción muscular, los filamentos gruesos realizan movimientos de pivote, y tiran de los filamentos delgados hacia la mitad del sarcómero. Esto produce el deslizamiento de las fibras gruesas y delgadas.
Así, la longitud de los filamentos gruesos y delgados se mantiene constante, pero incrementa el solapamiento entre ambos filamentos. La longitud del sarcómero disminuye por el anclaje de filamentos delgados a los discos Z.
¿Cómo se detiene la contracción muscular?
El ATP es la moneda energética de la célula. Por ello, esta casi siempre disponible en los tejidos musculares vivos. Tomando en cuenta lo anterior, deben existir mecanismos que permitan la relajación del músculo y la detención de las contracciones.
Dos proteínas, denominadas tropomiosina y troponina, tienen un papel fundamental en este fenómeno. Estas trabajan en conjunto para lograr bloquear los sitios de unión de la miosina (impidiendo así su unión con la actina). Como resultado, el músculo se relaja.
Contrariamente, cuando un animal muere experimenta un fenómeno conocido como rigor mortis. El responsable de este endurecimiento del cadáver es el bloqueo de la interacción entre la miosina y la actina, poco tiempo después de la muerte del animal.
Una de las consecuencias de este fenómeno es la necesidad de ATP para la liberación de las dos moléculas de proteínas. Lógicamente, en los tejidos muertos no hay disponibilidad de ATP y no puede ocurrir esta liberación.
El mismo mecanismo que describimos (más adelante profundizaremos en el mecanismo que subyace al movimiento) no se restringe a las contracciones musculares de los animales. Es el responsable de los movimientos de tipo ameboidales que observamos en las amebas y en algunos mohos coloniales.
Del mismo modo, el movimiento citoplasmático que observamos en las algas y en las plantas terrestres está dirigido por mecanismos similares.
La contracción del tejido del músculo liso y las células produce un aumento de actina F y una disminución de actina G. La polimerización de actina se produce en tres etapas: 1) nucleación, un paso lento; 2) elongación, un paso rápido; y 3) estado estable. La velocidad de polimerización es igual a la velocidad de despolimerización.
El filamento de actina crece más rápido por el extremo (+) que el extremo (–). La velocidad de elongación es proporcional a la concentración de monómeros de actina en equilibrio con filamentos de actina, denominada concentración crítica (Cc).
La Cc para el extremo (+) es 0,1 µM, y para el extremo (–) es 0,8 µM. Esto significa que se requiere 8 veces menos concentración de monómeros de actina para polimerizar el extremo (+).
La polimerización de la actina está regulada principalmente por la timosina beta4 (TB4). Esta proteína une actina G y la retiene, evitando que polimerice. Mientras que la profilina estimula la polimerización de la actina. La profilina se une a los monómeros de actina facilitando la polimerización por el extremo (+), mediante la disociación del complejo actina–TB4.
Otros factores como el incremento de iones (Na+, K+ o Mg+2) favorecen la formación de filamentos.
La formación del citoesqueleto de actina requiere la elaboración de enlaces cruzados entre filamentos de actina. Estos enlaces los forman proteínas, cuyas características resaltantes son: poseen dominios de unión a la actina; muchas tienen dominios homólogos a la calponina; y cada tipo de proteína se expresa en un determinado tipo de célula.
En filopodios y fibras de estrés, los enlaces cruzados entre filamentos de actina los realizan la fascina y la filamina. Estas proteínas, respectivamente, hacen que filamentos de actina sean paralelos o que tengan distintos ángulos. Por ello, los filamentos de actina definen la forma de la célula.
La región de la célula con mayor cantidad de filamentos de actina se encuentra cerca de la membrana plasmática. A esta región se la denomina corteza. El citoesqueleto cortical se organiza en diferentes formas, dependiendo del tipo de célula, y se conecta a la membrana plasmática a través de proteínas fijadoras.
Algunos de los citoesqueletos mejor descritos son de células del músculo, plaquetas, células epiteliales y eritrocitos. Por ejemplo, en las células músculares, la proteína fijadora distrofina une los filamentos de actina a un complejo glucoproteico integral de la membrana. Este complejo se une a proteínas de la matriz extracelular.
Los investigadores liderados por Rayment propusieron un modelo de cuatro pasos para explicar la interacción de la actina y la miosina. El primero paso se da con la unión del ATP a las cabezas de la miosina. Esta unión genera un cambio conformacional en la proteína, liberándola de la actina en el filamento pequeño.
Luego, el ATP es hidrolizado a ADP, liberando un fosfato inorgánico. La molécula de miosina se ancla a una nueva subunidad de actina, generando un estado de alta energía.
La liberación del fosfato inorgánico trae consigo un cambio en la miosina, volviendo a la conformación inicial y ocurriendo el movimiento de los filamentos pequeños, con respecto a los filamentos gruesos. Este movimiento causa el movimiento de los dos extremos del sarcómero, acercándolos.
El último paso involucra la liberación del ADP. En este punto la cabeza de la miosina se encuentra libre y puede unirse a una nueva molécula de ATP.
La motilidad reptante es un tipo de motilidad de las células. Los pasos de este tipo de motilidad son: proyección del eje líder de adhesión hacia el sustrato; adhesión al sustrato; retracción trasera; y des–adhesión.
La proyección del eje líder requiere de la participación de proteínas, las cuales participan en la polimerización y despolimerización de filamentos de actina. El eje líder se encuentra en la corteza celular, denominada lamellipodio. Los pasos de proyección del eje son:
– Activación de receptores por señal extracelular.
– Formación de GTPasas activas y 4,5–bisfosfato fosfoinositol (PIP2).
– Activación de las proteínas WASp/Scar y Arp2/3, que se unen a los monómeros de actina para formar ramificaciones en los filamentos de actina.
– Crecimiento rápido de los filamentos de actina, por el extremo decorado con miosina, de la ramificación. Se produce el empuje de la membrana hacia adelante.
– Culminación de la elongación producida por proteínas de cubierta.
– Hidrólisis del ATP unido a la actina en los filamentos más viejos.
– Despolimerización de la actina-ADP de los filamentos promovida por ADF/cofilina.
– Intercambio de ADP por ATP catalizado por profilina, generando actina G–ATP lista para comenzar a elongar ramificaciones.
La distrofia muscular es una enfermedad degenerativa del músculo esquelético. Se hereda recesivamente y está ligada al cromosoma X. Afecta principalmente a varones con una frecuencia alta en la población (uno de cada 3.500 varones). Las madres de estos varones son heterocigotas asintomáticas, y pueden carecer de historial familiar.
Hay dos formas de distrofia muscular, Duchenne y Becker, y ambas son ocasionadas por defectos en el gen de la distrofina. Estos defectos consisten en deleciones que eliminan axones.
La distrofina es una proteína (427 KDa) que forma enlaces cruzados entre los filamentos de actina. Posee un dominio de unión a la actina en el N–terminal, y un dominio de unión a la membrana en el C–terminal. Entre ambos dominios hay un tercer dominio tubular formado por 24 repeticiones en tándem.
En el retículo cortical muscular, la distrofina participa en la unión de los filamentos de actina a la membrana plasmática mediante un complejo glucoproteico. Este complejo también se une a las proteínas de la matriz extracelular.
En los pacientes que carecen de distrofina funcional, con distrofia muscular de Duchenne, el citoesqueleto cortical no sostiene la membrana plasmática. En consecuencia, la membrana plasmática se daña con el estrés de las contracciones musculares repetidas.
- Devlin, T.M. 2000. Bioquímica. Editorial Reverté, Barcelona.
- Gunst, S.J., and Zhang, W. 2008. Actin cytoskeletal dynamic in smooth muscle: a new paradigm for the regulation of smooth muscle contraction. Am J Physiol Cell Physiol, 295: C576-C587.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Biología celular y molecular. Editorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, México, Sāo Paulo.
- Nelson, D. L., Cox, M. M. 2008. Lehninger–Principles of biochemistry. W.H. Freeman, New York.
- Pfaendtner, J., De La Cruz, E. M., Voth, G. 2010. Actin filament remodeling by actin depolymerization factor/cofilin. PNAS, 107: 7299–7304.
- Pollard, T.D., Borisy, G.G. 2003. Cellular Motility Driven by Assembly and Disassembly of Actin Filaments. Cell, 112: 453–465.
