Citocromo c oxidasa: estructura, funciones, inhibidores
La citocromo c oxidasa es un complejo de proteínas enzimáticas que pueden atravesar la bicapa lipídica de la membrana celular. Es hemosoluble y se halla principalmente asociada a la membrana interna de las mitocondrias, encontrándose tanto en organismos procariotas (bacterias), como en eucariotas (unicelulares y pluricelulares).
También llamada complejo IV, esta enzima es vital en las funciones metabólicas aeróbicas de los organismos, pues es esencial en la cadena de transporte de electrones en la cual la célula quema azúcares y captura parte de la energía liberada para almacenar adenosín trifosfato o ATP.
El nombre citocromo significa “pigmentos celulares”. Se trata de proteínas sanguíneas que transportan electrones. Los citocromos fueron descubiertos por el medico irlandés Charles Alexander MacMunn en 1884. MacMunn fue pionero en descubrir el pigmento respiratorio de la sangre, llamado hoy en día citocromo 1.
En los años 20 del siglo pasado el entomólogo y parasitólogo ruso David Keilin redescubrió y caracterizó los pigmentos respiratorios y fue quien los nombró citocromos. Si bien MacMunn los había descubierto en 1884, la comunidad científica lo había olvidado e incluso algunos habían mal interpretado su trabajo.
Índice del artículo
- 1 Características generales
- 2 La citocromo c oxidasa o Complejo IV
- 3 Estructura
- 4 Funciones
- 5 Inhibidores
- 6 Deficiencia
- 7 Usos en filogenia
- 8 Referencias
En general, los pigmentos respiratorios presentan unos espectros de luz visible característicos. Se sabe que existen al menos cuatro complejos de proteínas de membrana integral en donde hay 5 tipos diferentes de citocromos: a, a3, b, c1 y c, clasificados según las longitudes de onda de los máximos de absorción espectral.
Se encuentran generalmente en la membrana interna de las mitocondrias. Sin embargo también han sido observadas en el retículo endoplasmático y los cloroplastos, en organismos eucariotas y procariotas.
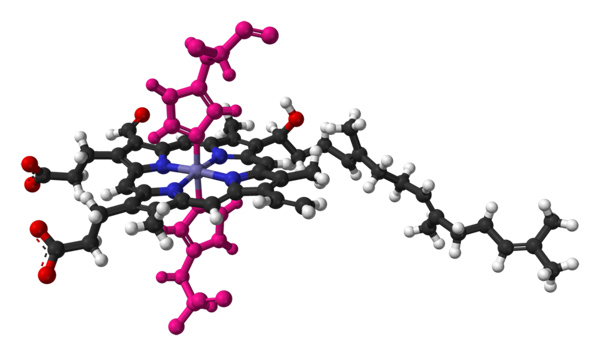
Presentan el grupo prostético hemo que contiene hierro (Fe). Cada uno de los citocromos conocidos actúa en complejos multienzimáticos en el transporte de electrones del proceso o cadena respiratoria.
Los citocromos tienen la función de participar en reacciones de oxido-reducción. Las reacciones de reducción, donde aceptan electrones, ocurren de forma diferente para cada tipo de citocromo, y su valor es determinado por el flujo de electrones de la cadena respiratoria.
Se conocen cuatro clases de citocromo c, que son las siguientes.
Clase I
Dentro de esta clase se encuentran los citocromos c solubles de bajo giro (lowspin), presentes en bacterias y mitocondrias. Son octaédricos. El sitio de unión hemo se halla en el extremo N de la histidina y el sexto ligando es suministrado por un residuo de metionina en el extremo C.
De esta clase se pueden incluso reconocer varias subclases, a las cuales se les han determinado su estructura tridimensional.
Clase II
En esta clase se hallan los citocromos c de alto giro (highspin) y algunos de bajo giro. Los de alto giro tienen el sitio de unión cercano al extremo-C, y en los de bajo giro el sexto ligando parece ser un residuo de metionina cerca del extremo N (N-terminus en inglés). Son pentacoordinados con histidina de quinto ligando.
Clase III
Esta clase se caracteriza por presentar citocromos c con hemo multiple (c3 y c7) y un bajo potencial oxido-reductor, con apenas 30 residuos de aminoácidos por grupo hemo. En los representantes de esta clase, los grupos hemo c tienen estructura y funciones no equivalentes, además de presentar diferentes potenciales redox. Son octaédricos.
Clase IV
Según algunos autores, esta clase fue creada únicamente para incluir proteínas complejas que presentan otros grupos prostéticos, así como hemo c, o flavocitocromo c, entre otros.
La citocromo c oxidasa es una enzima mitocondrial que lleva a cabo la fase final del transporte electrónico en la respiración celular. Esta enzima cataliza el transporte de electrones desde el citocromo c reducido hasta el oxígeno.
Algunos compuestos químicos como el cianuro, el dióxido de carbono y la azida, pueden llegar a inhibir el funcionamiento de la esta enzima, provocando la llamada asfixia química celular. Otras formas de inhibición del complejo IV son las mutaciones genéticas.
Desde el punto de vista evolutivo, la citocromo c oxidasa solo se encuentra en organismos aeróbicos, y varios grupos de científicos sugieren que la presencia de esta proteína indica relaciones evolutivas en donde plantas, hongos y también animales compartieron un ancestro en común.
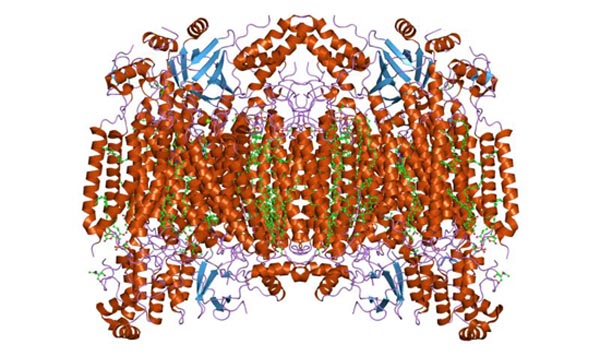
La citocromo c oxidasa forma un complejo homodimérico, es decir, compuesto por dos monómeros similares en la membrana interna de las mitocondrias. El complejo enzimático consta de 3 a 4 subunidades en organismos procariontes y hasta un máximo de 13 (algunos sugieren 14) polipéptidos en organismos como los mamíferos.
En estos organismos 3 polipéptidos son de origen mitocondrial y el resto se originan en el núcleo. Cada monómero posee 28 hélices transmembrana que separan dominios hidrófilos frente a la matriz de la membrana y el espacio intermembrana.
Tiene una sola unidad catalítica, que se halla en todas las enzimas que catalizan reacciones de oxidación/reducción, empleando oxígeno molecular (oxidasas, especialmente las hemo-cobre). El complejo contiene los citocromos a y a3 unidos por la subunidad I y dos centros de cobre.
Presenta uno o varios grupos hemo c ligados a la estructura proteica circundante por uno o varios (generalmente dos) enlaces tioéter. Otros autores sugieren que existe un único grupo hemo c unido de forma covalente a la proteína entre el anillo de porfirina y dos residuos de cisteína.
El único grupo hemo c mencionado anteriormente, se encuentra rodeado por residuos hodrofóbicos y está hexacoordinado, estando la histidina en la posición 18 de la cadena polipeptídica y la metionina en la 80.
Las citocromo c oxidasas son protagonistas en tres mecanismos fisiológicos primordiales, que veremos a continuación.
La apoptosis es la destrucción o muerte celular programada, causada por el mismo organismo y que tiene como fin controlar el crecimiento, el desarrollo, la eliminación de tejidos dañados y la regulación del sistema inmune. En dicho proceso fisiológico la citocromo c oxidasa participa como un intermediario.
Esta proteína, liberada por las mitocondrias, conduce a una interacción con el retículo endoplasmático, que provoca la secreción o liberación de calcio. El aumento progresivo de calcio desencadena una liberación masiva de citocromo c oxidasa, hasta que se logra llegar a niveles citotóxicos de calcio.
Los niveles citotóxicos de calcio y la liberación de las citocromos c causan la activación en cascada de varias enzimas caspasas, que son las responsables de la destrucción de las células.
Varios estudios indican que cuando la citocromo c oxidasa es expuesta a longitudes de onda de 670 nanómetros, participa en un complejo funcional, que penetra en el tejido dañado o herido y aumenta la velocidad de regeneración celular.
Esta es quizás la más conocida y la función más relevante de la citocromo c oxidasa. Es precisamente el complejo oxidasa (de la cadena respiratoria) el encargado de recoger los electrones del citocromo c y trasnferirlos a la molécula de oxígeno, reduciéndola a dos moléculas de agua.
Conectado a dicho proceso, se produce una traslocación de protones a través de la membrana, dando como resultado la generación de un gradiente electroquímico que el complejo ATP sintetasa, utiliza para producir o sintetizar ATP (adenosín trifisfato).
El citocromo c oxidasa es inhibido por varios procesos y compuestos químicos. La forma en que ocurre puede surgir como una manera natural para regular la producción o acción de la enzima o puede ocurrir de forma accidental debido a intoxicaciones.
En presencia de azida, cianuro o monóxido de carbono, el citocromo c oxidasa se une a estos y se inhibe el funcionamiento del complejo proteico. Esto causa una interrupción en el proceso respiratorio celular y por ende provoca la asfixia química de las células.
Otros compuesto como óxido nítrico, sulfuro de hidrógeno, metanol, y algunos alcoholes metilados, también causan inhibición de la citocromo c oxidasa.
La citocromo c oxidasa es una enzima que es controlada por genes tanto del núcleo como de las mitocondrias. Existen alteraciones genéticas o mutaciones que pueden conllevar una deficiencia de la citocromo c oxidasa.
Estas mutaciones perturban la funcionalidad de la enzima, ya que alteran su estructura enzimática, trayendo consigo desórdenes metabólicos durante el desarrollo embrionario (según estudios en humanos), que posteriormente afectarán al organismo en sus primeros años de vida.
La deficiencia de citocromo c oxidasa afecta a tejidos con alta demanda energética, como corazón, hígado, cerebro y la musculatura. Los síntomas de estas mutaciones se ven reflejados antes de los dos años de vida y pueden manifestarse como afecciones fuertes o leves.
Los síntomas leves pueden observarse incluso poco después del primer año de edad y por lo general los individuos con ellos solamente presentan disminución de la tensión muscular (hipotonía) y atrofia muscular (miopatía).
Por otra parte, los individuos que presentan síntomas más fuertes, pueden llegar a tener atrofia muscular y encefalomiopatía. Otras afecciones causadas por la ausencia de citocromo c oxidasa son miocardiopatía hipertrófica, aumento patológico del tamaño del hígado, síndrome de Leigh y acidosis láctica.
La filogenia es la ciencia que se encarga de los estudios del origen, formación y desarrollo evolutivo desde el punto de vista ancestro-descendiente, de los organismos. En las últimas décadas, estudios de filogenia con análisis moleculares han sido cada vez más frecuentes, arrojando mucha información y resolviendo problemas taxonómicos.
En este sentido, algunos estudios filogenéticos indican que el uso de las citocromo c oxidasas puede ayudar a establecer relaciones evolutivas. Esto es debido a que este complejo de proteínas es altamente conservado y está presente en una gran variedad de organismos, que van desde los protistas unicelulares, hasta los grandes vertebrados.
Ejemplo de esto, son las pruebas hechas con humanos, chimpancés (Pan paniscus) y macacos Rhesus (Macaca mulatta). Tales pruebas revelaron que las moléculas de citocromo c oxidasa de humanos y chimpancés eran idénticas.
Además mostró que las moléculas de citocromo c oxidasa del macaco Rhesus diferían en un aminoácido de las de los dos primeros, reafirmando en consecuencia relaciones ancestro-descendientes, entre chimpancés y humanos.
- R.P. Ambler (1991). Sequence variability in bacterial cytochromes c. Biochimica et Biophysica Acta (BBA) – Bioenergetics.
- Cytochrome c. Recuperado de newworldencyclopedia.org.
- V.Colman, E. Costa, R. Chaves, V. Tórtora (2015). Roles biológicos del citocromo c: transporte electrónico mitocondrial, muerte celular programada y ganancia de actividad peroxidática. Anales de la Facultad de Medicina.
- Cytochrome c oxidase subunit I. Recuperado de ebi.ac.uk.
- L. Youfen, P. Jeong-Soon, D. Jian-Hong & B. Yidong (2007). Cytochrome c Oxidase Subunit IV is Essential for Assembly and Respiratory Function of the Enzyme Complex. Journal of Bioenergetics and Biomembranes.
- Gene group: Mitochondrial complex IV: cytochrome c oxidase subunits (COX, MT-CO). Recuperado de genenames.org.
- E.F. Hartree (1973). The discovery of cytochrome. Biochemical Education.
- Citocromo c oxidasa, deficiencia de…. Recuperado de ivami.com.
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biochemestry. 3th edition. Benjamin / Cummings Publishing Company, Inc.
