Células NK: características, funciones, tipos, valores
Las células NK (del inglés Natural Killer cells), células asesinas naturales o células citocidas naturales, son un tipo de linfocito efector que participa en las respuestas del sistema inmune innato o inespecífico.
Dichas células fueron descubiertas hace más de 40 años y algunos autores las describen como “linfocitos granulares” que, a diferencia de los linfocitos T y B, participan en la respuesta inmune innata y no sufren procesos de rearreglo genético en sus líneas germinales.
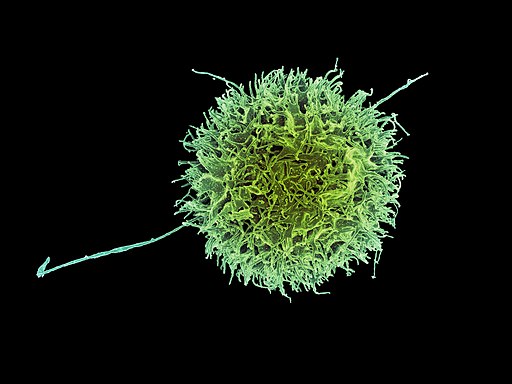
En vista de que no expresan los marcadores comunes para las otras dos clases de linfocitos, las células NK fueron inicialmente denominadas “células nulas”. No obstante, estudios ulteriores demostraron que se trataba de linfocitos con granulocitos de gran tamaño.
Estas células son capaces de controlar distintos tipos de tumores e infecciones microbianas al limitar su dispersión y el daño de los tejidos. Además, pueden lisar distintos tipos de células sin una estimulación antigénica definida.
Las NK son células sumamente importantes en la primera línea de defensa contra patógenos, hecho que ha sido demostrado a través de estudios en los que seres humanos deficientes de células NK pueden sufrir infecciones letales durante la niñez.
Índice del artículo
- 1 Características de las células NK
- 2 Funciones
- 3 Tipos
- 4 Valores normales
- 5 Activación y maduración
- 6 Mecanismo de acción
- 7 Marcadores
- 8 Referencias

Las células NK se encuentran en menor proporción que cualquiera de las otras dos clases de linfocitos (constituyen del 2 al 10% de los linfocitos circulantes) y, puesto que pertenecen al sistema innato de defensa, se piensa que fueron de los primeros elementos celulares implicados en la protección de los organismos multicelulares.
Al igual que los linfocitos T y los linfocitos B, las células NK son parte del sistema hematopoyético de los mamíferos y derivan de las células hematopoyéticas progenitoras que expresan los marcadores membranales CD34+, que también se conocen como las células HPC.
Mientras que se sabe que los linfocitos T maduran en el timo y que los linfocitos B hacen lo propio en la médula ósea, los intentos para determinar la ruta de desarrollo completa de las NK a partir de los precursores HPC no han sido del todo exitosos; solo se sabe que son timo-independientes.
Las células NK expresan moléculas de adhesión en su superficie membranal conocidas como CD2, LFA-1, NCAM o CD56. También expresan receptores de baja afinidad a la porción constante (Fc) de la inmunoglobulina IgG que se denominan en conjunto FcγRIIIA o CD16.
El interior de una célula citocida natural está repleto de grandes gránulos citosólicos que están cargados con perforina, granzimas y proteoglucanos.
Las perforinas son proteínas formadoras de poros que “agujerean” la membrana plasmática de las células que son atacadas por las NK. Las granzimas, por otro lado, son serín proteasas que se hacen paso hacia las células a través de los poros formados por las perforinas y degradan proteínas intracelulares.
La acción combinada de las perforinas y las granzimas se traduce en el detenimiento de la producción de las proteínas virales o bacterianas y en la apoptosis o muerte celular programada de la célula infectada.
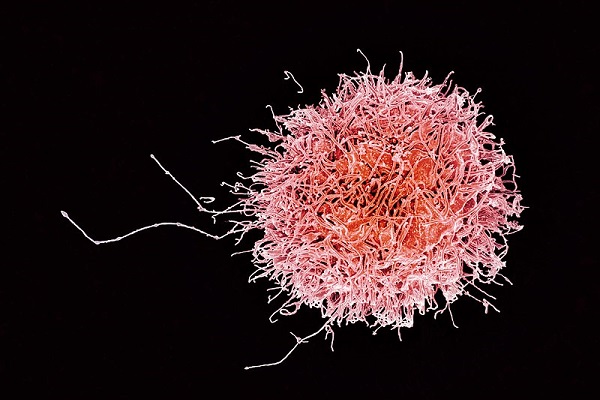
Las células asesinas naturales funcionan en la eliminación de células “blanco” o “diana” de forma natural, es decir, espontáneamente y sin mucha especificidad, dado que no requieren de ningún tipo de cebado antigénico.
Una de las funciones más importantes de este grupo de células es su capacidad de matar células tumorales, especialmente las pertenecientes a los linajes hematopoyéticos, así como también a células invadidas por distintos tipos de virus y/o bacterias.
Su actividad es fuertemente estimulada por factores como los interferones IFN-α y β, así como por la interleucina IL-12.
Gracias a que estas células producen algunas citocinas importantes para el sistema inmunológico, las NK participan en la regulación inmune, tanto en el sistema innato como en el adaptativo o específico.
Por ejemplo, la producción del interferón gamma (IFN-γ) en las células NK puede perturbar la participación de los macrófagos en la inmunidad innata, pues esta molécula interfiere con las actividades fagocíticas y microbicidas.
Al mismo tiempo, el IFN-γ producido por las citocidas naturales puede modificar el compromiso de poblaciones enteras de células T colaboradoras, puesto que el IFN-γ también inhibe la expansión y el desarrollo de una población respecto a otra.
Las células NK representan la primera línea de defensa durante las infecciones de origen viral, ya que controlan la replicación de los virus mientras se activan, proliferan y se diferencian las células T citotóxicas, lo que puede tomar más de 6 días.
Las poblaciones de células NK son bastante heterogéneas, tanto fenotípica como funcional y anatómicamente. Además, sus características dependen del tipo de organismo que se estudie.
En el modelo murino (ratón) se han descrito tres conjuntos diferentes de células citocidas naturales que difieren entre sí por la expresión de los marcadores CD11b y CD27. En este sentido, existen las células CD11bdullCD27+, las CD11b+CD27+ y las CD11b+CD27dull.
El superíndice “dull” se refiere a “apagado” o “inactivo” y se emplea, en este caso, para describir el estado del mismo en la superficie de las células murinas.
Las células CD11bdullCD27+ se diferencian a partir de un precursor del tipo doble positivo (CD11b+CD27+) que, a su vez, da lugar al tipo más maduro de células NK en roedores: las CD11b+CD27dull.
Tanto las líneas dobles positivas como las CD11b+CD27dull se caracterizan por eliminar a sus células blanco y por secretar una citoquina conocida como interferón (INF-γ). Empero, estas últimas están en algo que se denomina “senescencia replicativa”.
Los tres tipos de células NK se distribuyen en diferentes tejidos. Las células CD11bdullCD27+ están predominantemente en los nódulos linfáticos y en la médula ósea. Las células CD11b+CD27dull son abundantes en la sangre, el bazo, los pulmones y el hígado; entretanto las células dobles positivas tienen una distribución más homogénea o sistémica.
Las células NK en los humanos también se clasifican de acuerdo con los marcadores de superficie que expresan, pero en este caso se diferencian por la presencia de los marcadores CD56dim y CD56bright. Los superíndices “dim” y “bright” se refieren a “oscuro” y “claro”, respectivamente.
Las diferencias entre estas células radican en las propiedades de “búsqueda de blancos” de cada una, que están dadas por la presencia de uno u otro marcador.
En la sangre periférica y en el bazo de los seres humanos el tipo principal de célula NK se conoce como CD56dimCD16+, que usualmente expresa la proteína porfirina y son citotóxicas. También producen IFN-γ como resultado de la interacción con células tumorales en condiciones in vitro.
En los nódulos linfáticos y las amígdalas se encuentran las células CD56brightCD16- que, en lugar de producir porfirina, secretan la citoquina IFN-γ como respuesta a la estimulación por las interleucinas IL-12, IL-15 e IL-18.
Se piensa que, en los humanos y los roedores, las amígdalas y otros órganos linfoides secundarios pueden ser los sitios de producción y maduración de la mayor parte de las células NK.
Algunos estudios sugieren que existe cierta similitud entre las células CD56bright de los humanos y las células CD11dull de los roedores desde el punto de vista de ubicación anatómica, características fenotípicas, contenido citosólico de perforina, potencial proliferativo y expresión superficial de la interleucina IL-7R.
Estas tienen una vida media bastante corta (2 semanas, aproximadamente) y se cree que en un ser humano adulto existen alrededor de 2 billones de células en circulación. Son abundantes en la sangre, en el bazo y en otros tejidos linfoides y no linfoides.
Estudios demuestran que la concentración normal en hombres y mujeres adultos está alrededor de más o menos 200 y 600 células por microlitro de sangre evaluada.
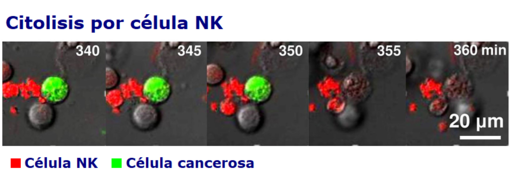
La intensidad y la calidad de las respuestas citotóxicas de las células NK depende del microambiente generado por las citoquinas y de la interacción con otras células del sistema inmune, especialmente con las células T, las células dendríticas y los macrófagos.
Entre las citoquinas activadoras de las células NK están las interleucinas, específicamente IL-12, IL-18 e IL-15; así como también el interferón tipo I (IFN-I). Interferón e interleucinas son potentes activadores de la función efectora de las NK.
La interleucina IL-2 también participa en la promoción de la proliferación, citotoxicidad y secreción de citoquinas por parte de las células NK.
IL-15 es crucial para la diferenciación de las NK, mientras que IL-2 e IL-18 son imprescindibles para la maduración posterior de tales células.
Las células citocidas naturales se activan gracias al reconocimiento de moléculas propias (proceso conocido en inglés como “recognition of self molecules”) que son expresadas constitutivamente bajo condiciones de estado estacionario.
En sus membranas, estas células expresan distintos miembros de una familia de proteínas de superficie que contienen dos o tres dominios tipo inmunoglobulina en sus porciones extracelulares y motivos similares a los dominios de activación de los inmunorreceptores vía tirosina en su región intracelular.
Cada célula NK puede expresar una o más de estas proteínas receptoras y cada receptor es capaz de reconocer una forma específica de una molécula del complejo mayor de histocompatibilidad de clase I (MHC-I).
El reconocimiento entre esta molécula y el receptor en la superficie de las células citocidas naturales conlleva a la formación de un complejo con abundantes péptidos derivados de proteínas “propias”.
Los receptores son en su mayoría proteínas inhibidoras que activan a una tirosina fosfatasa que impide que la célula emita respuestas normales.
La eliminación o muerte mediada por células asesinas naturales es similar a la que ocurre durante la acción citolítica de los linfocitos T CD8 (citotóxicos), aunque la diferencia radica en que las NK son citotóxicas constitutivas, es decir, que no necesitan activarse antes.
Las NK activas expresan el ligando FasL, por lo que inducen con relativa facilidad la muerte de las células blanco que expresan en su superficie la proteína Fas.
Tras la formación del completo FasL/Fas, ocurre un proceso conocido como “desgranulación”, que termina con la liberación de porfirina y granzimas en los sitios de contacto intercelulares.

A pesar de las mencionadas similitudes, las NK difieren de los mecanismos mediados por las células T citotóxicas en que el reconocimiento de sus células diana no depende de proteínas del complejo mayor de histocompatibilidad.
Otra diferencia es que las células NK no tienen un sistema de “memoria inmunológica”, lo que se demuestra en el hecho de que su actividad no incrementa después de una segunda exposición a sus células blanco.
Las citocidas naturales distinguen entre una célula sana y otra infectada o tumoral (cancerosa) gracias a un balance de señales activadoras e inhibidoras, que son reconocidas por receptores superficiales específicos.
Estos receptores dos de dos tipos: tipo lectina (proteínas de unión a carbohidratos y a otras proteínas) y tipo inmunoglobulina (similares a la región constante de las inmunoglobulinas).
En este último grupo se reconocen los receptores tipo inmunoglobulina de las células asesinas o KIR (del inglés killer-cell immunoglobulin-like receptors), capaces del reconocimiento y unión de formas específicas de las proteínas del complejo mayor de histocompatibilidad de clase I (HLA-B o HLA-C).
Es importante resaltar que las NK no “atacan” células que expresan niveles normales de moléculas del MHC de clase I, pero sí matan células que expresan moléculas foráneas de este tipo o aquellas que carezcan de dichos marcadores (lo que es típico en células tumorales e infectadas por virus).
Las NK expresan algunos marcadores de membrana comunes para los monocitos y los granulocíticos, y otros típicos de los linfocitos T.
Por otra parte, las citocidas naturales expresan grupos distintos de marcadores superficiales, pero aún no se sabe a ciencia cierta si la heterogeneidad indica subpoblaciones celulares o etapas durante su activación o maduración.
Algunos ejemplos de los marcadores de las células NK son:
Las células NK derivan del mismo progenitor que da lugar a las células T. Esta célula progenitora usualmente expresa los marcadores CD7, CD2 y ocasionalmente el CD5.
CD2 es una proteína de 50 kDa de peso molecular que también está presente en las células T. Se conoce como una molécula superficial de adhesión y participa en la activación de las células T.
CD5 está presente normalmente en las células T y en algunas subpoblaciones de células B. Es un marcador de 67 kDa y también tiene funciones adhesivas.
El marcador CD7 es típico de las células madre hematopoyéticas y también se ha conseguido en determinadas subpoblaciones de células T. Tiene 40 kDa de peso molecular y funciona en la transducción de señales.
Este receptor es compartido entre las NK, monocitos y granulocitos. Tiene 165 kDa de peso molecular y es capaz de asociarse con otros marcadores de superficie. Sus funciones principales son adhesivas, especialmente durante los procesos de fagocitosis u “opsonización”.
Es un receptor de entre 50 y 70 kDa que está unido a una molécula de fosfatidil inositol transmembranal. Participa en la activación de las células asesinas naturales y también se encuentra en los granulocitos y macrófagos.
También tiene funciones como receptor para la región constante de la cadena gamma de algunos anticuerpos.
Se encuentra en la mayoría de los linfocitos T y es un homodímero de cadenas peptídicas de 55 kDa. Aparentemente es miembro de la familia de los receptores del factor de necrosis tumoral (TNF-R) y también participa en la co-estimulación de las células T.
Este receptor es único para las células NK y está compuesto por cadenas de 135 y 220 kDa. Participa en la adhesión “homotípica” de dichas células.
- Abbas, A., Lichtman, A., & Pober, J. (1999). Inmunología Celular y Molecular (3rd ed.). Madrid: McGraw-Hill.
- Burmester, G., & Pezzutto, A. (2003). Color Atlas of Immunology With contributions by. New York, USA: Thieme.
- Caligiuri, M. A. (2008). Human natural killer cells. Blood, 112, 461–469.
- Kindt, T., Goldsby, R., & Osborne, B. (2007). Inmunología de Kuby (6th ed.). México D.F.: McGraw-Hill Interamericana de España.
- Mandal, A., & Viswanathan, C. (2015). Natural killer cells: In health and disease. Hematol Oncol Stem Cell Ther, 1–9.
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., & Ugolini, S. (2008). Functions of natural killer cells. Nature Immunology, 9(5), 503–510.
- Vivier, E., Zitvogel, L., Lanier, L. L., Yokoyama, W. M., & Ugolini, S. (2011). Innate or Adaptive Immunity? The Example of Natural Killer Cells. Science, 331, 44–49.
