Fase dispersa: qué es, características y ejemplos
¿Qué es la fase dispersa?
La fase dispersa es la que está en menor proporción en una dispersión y se compone de agregados de partículas muy pequeñas. Mientras, la fase más abundante y continua donde yacen las partículas se llama fase dispersante. Un ejemplo es el agua con azúcar, donde la fase dispersa sería el azúcar y la dispersante el agua.
Las dispersiones se clasifican de acuerdo con el tamaño de las partículas que forman la fase dispersa, pudiéndose distinguir tres tipos de dispersiones: las dispersiones groseras, las disoluciones coloidales y las disoluciones verdaderas.
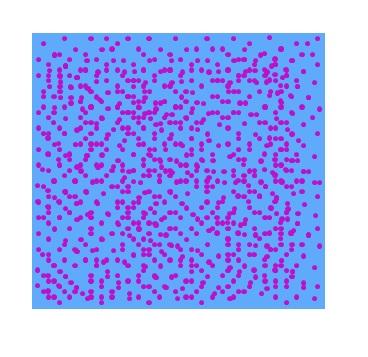
En la imagen superior puede apreciarse una fase dispersa hipotética de partículas moradas en agua. Como resultado, un vaso lleno de esta dispersión no mostrará transparencia a la luz visible; es decir, lucirá igual que un yogur líquido de color morado. El tipo de dispersiones varía en función del tamaño de esas partículas.
Cuando son “grandes” (10-7 m) se habla de dispersiones groseras, y pueden sedimentar por acción de la gravedad; disoluciones coloidales, si sus tamaños oscilan entre 10-9 m y 10-6 m, lo cual hace que sean visibles solo con ultramicroscopio o microscopio electrónico; y disoluciones verdaderas, si sus tamaños son menores a 10-9 m, siendo capaces de atravesar membranas.
Las disoluciones verdaderas son, por lo tanto, todas aquellas que se conocen popularmente, como el vinagre o el agua azucarada.
Características de la fase dispersa
Las disoluciones constituyen un caso particular de las dispersiones, siendo estas de gran interés para el conocimiento de la fisioquímica de los seres vivos. La mayoría de las sustancias biológicas, tanto intracelulares como extracelulares, se encuentran en la forma de las llamadas dispersiones.
Movimiento browniano y efecto Tyndall
Las partículas de la fase dispersa de las disoluciones coloidales tienen un tamaño pequeño que dificulta su sedimentación. Además, las partículas se mueven constantemente en un movimiento al azar, chocando entre sí, lo que también dificulta su sedimentación. Este tipo de movimiento es conocido como browniano.
Debido al tamaño relativamente grande de las partículas de la fase dispersa, las disoluciones coloidales tienen un aspecto turbio o aún opaco. Esto es debido a que la luz se dispersa cuando atraviesa el coloide, fenómeno conocido como efecto Tyndall.
Heterogeneidad
Los sistemas coloidales son sistemas no homogéneos, ya que la fase dispersa está formada por partículas con un diámetro comprendido entre 10-9 m y 10-6 m. Mientras que las partículas de las disoluciones son de un tamaño menor, generalmente inferior a 10-9 m.
Las partículas de la fase dispersa de las disoluciones coloidales pueden atravesar el papel de filtro y el filtro de arcilla. Pero no pueden atravesar las membranas de diálisis como el celofán, el endotelio capilar y el colodión.
En algunos casos, las partículas que forman la fase dispersa son proteínas. Cuando están en fase acuosa, las proteínas se pliegan, quedando la parte hidrofílica hacia el exterior para una interacción mayor con el agua, a través de las fuerzas ion-dípolo o con la formación de puentes de hidrógeno.
Las proteínas forman un sistema reticular en el interior de las células, pudiendo tomar una parte del dispersante. Además, la superficie de las proteínas sirve para unir moléculas pequeñas que le confiere una carga eléctrica superficial, lo cual limita la interacción entre las moléculas proteicas, evitando que constituyan coágulos que provoquen su sedimentación.
Estabilidad
Los coloides se clasifican según la atracción entre la fase dispersa y la fase dispersante. Si la fase dispersante es líquida, los sistemas coloidales se clasifican como soles. Estos se subdividen en liófilos y liófobos.
Los coloides liófilos pueden formar soluciones verdaderas y son termodinámicamente estables. Por otro lado, los coloides liófobos pueden formar dos fases, ya que son inestables, aunque estables desde el punto de vista cinético. Esto les permite mantenerse en estado disperso por mucho tiempo.
Ejemplos de fase dispersa
Tanto la fase dispersante como la fase dispersa pueden presentarse en los tres estados físicos de la materia, es decir: sólido, líquido o gaseoso.
Normalmente, la fase continua o dispersante se encuentra en estado líquido, pero pueden encontrarse coloides cuyos componentes se encuentran en otros estados de agregación de la materia.
Las posibilidades de combinación de la fase dispersante y la fase dispersa en esos estados físicos son nueve.
Se explicará cada uno con algunos respectivos ejemplos.
– Disoluciones sólidas: cuando la fase dispersante es sólida, puede combinarse con una fase dispersa en estado sólido, formando las llamadas disoluciones sólidas.
Son ejemplos de estas interacciones: muchas aleaciones del acero con otros metales, algunas gemas coloridas, el caucho reforzado, la porcelana y los plásticos pigmentados.
– Emulsiones sólidas: la fase dispersante en estado sólido puede combinarse con una fase dispersa líquida, formando las llamadas emulsiones sólidas. Son ejemplos de estas interacciones: el queso, la mantequilla y la jalea.
– Espumas sólidas: la fase dispersante como un sólido puede combinarse con una fase dispersa en estado gaseoso, constituyendo las llamadas espumas sólidas. Son ejemplos de estas interacciones la esponja, el hule, la piedra pómez y el hule espuma.
– Soles y geles: la fase dispersante en estado líquido se combina con la fase dispersa en estado sólido, formando los soles y los geles. Son ejemplos de estas interacciones la leche de magnesia, las pinturas, el lodo y el pudin.
– Emulsiones: la fase dispersante en estado líquido se combina con la fase dispersa también en estado líquido, produciendo las llamadas emulsiones. Son ejemplos de estas interacciones la leche, la crema facial, los aderezos de ensaladas y la mayonesa.
– Espumas: la fase dispersante en estado líquido se combina con la fase dispersa en estado gaseoso, formando las espumas. Son ejemplos de estas interacciones la crema de afeitar, la crema batida y la espuma de la cerveza.
– Aerosoles sólidos: la fase dispersante en estado gaseoso se combina con la fase dispersa en estado sólido, originando los llamados aerosoles sólidos. Son ejemplos de estas interacciones el humo, los virus, los materiales corpusculares en el aire, los materiales emitidos por los tubos de escape de los automóviles.
– Aerosoles líquidos: la fase dispersante en estado gaseoso se puede combinar con la fase dispersa en estado líquido, constituyendo los llamados aerosoles líquidos. Son ejemplos de estas interacciones la niebla, la bruma y el rocío.
– Disoluciones verdaderas: la fase dispersante en estado gaseoso se puede combinar con la fase gaseosa en estado gaseoso, formando las mezclas gaseosas que son disoluciones verdaderas y no sistemas coloidales. Son ejemplos de estas interacciones el aire y el gas del alumbrado.
Referencias
- Whitten, Davis, Peck & Stanley. Química (8.ª ed.). CENGAGE Learning.
- Toppr (s.f.). Classification of Colloids. Recuperado de: toppr.com
- Jiménez Vargas, J y Macarulla. J. M. (1984). Fisicoquímica Fisiológica, Sexta edición. Editorial Interamericana.
- Madhusha. Difference Between Dispersed Phase and Dispersion Medium. Recuperado de: pediaa.com
