Agar LIA (Lisina Hierro): fundamento, preparación y usos
El agar LIA (Lisina Hierro) es una prueba bioquímica utilizada para la identificación de bacterias de la familia Enterobacteriaceae. Este medio fue creado por Edwards y Fife, basados en la fórmula de Falkow.
Originalmente esta prueba era un caldo que contenía peptonas, extracto de levadura, glucosa, L-lisina, púrpura de bromocresol y agua destilada. Edwards y Fife le agregaron agar-agar, citrato férrico de amonio y tiosulfato sódico.
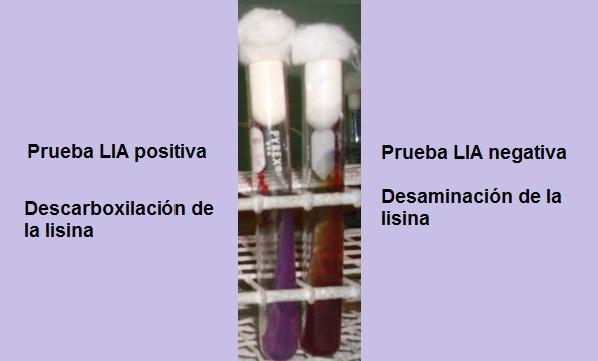
La prueba consiste básicamente en demostrar la presencia de la enzima lisina descarboxilasa, capaz de reaccionar con el grupo carboxilo del aminoácido L-lisina. También puede ocurrir una desaminación del aminoácido por la presencia de la enzima lisina desaminasa.
Adicionalmente, la composición del medio permite evidenciar la capacidad de algunos géneros bacterianos de producir sulfuro de hidrógeno. Finalmente, también es posible observar la generación o no de gas en el medio.
Índice del artículo
- 1 Fundamento
- 2 Interpretación de la prueba
- 3 Registro de los resultados
- 4 Preparación
- 5 Usos
- 6 Referencias
Como la mayoría de los medios de cultivos, el agar hierro lisina contiene componentes que proporcionan la fuente de nutrientes necesarias para el crecimiento bacteriano. Estos componentes están representados por las peptonas y el extracto de levadura.
Así mismo, este agar contiene como carbohidrato fermentable la glucosa. Se sabe que todas las bacterias de la familia Enterobacteriaceae fermentan la glucosa.
Este paso es crucial, porque se encargará de acidificar el medio, condición indispensable para que la enzima lisina descarboxilasa -si está presente- actúe sobre su sustrato.
En algunos géneros bacterianos se puede observar la producción de gas debido a la fermentación de la glucosa.
El gas se evidencia cuando ocurre un desplazamiento del agar en el tubo, quedando un espacio vacío en el fondo del mismo, o por fractura del medio en dos o más porciones.
Una vez descarboxilada la lisina, se forma una diamina (cadaverina) y anhídrido carbónico.
La descarboxilación se da en presencia de la coenzima fosfato de piridoxal. Esta reacción es irreversible.
Todos los cambios de pH ocurridos en el medio por las diversas reacciones, son detectados por el indicador de pH púrpura de bromocresol.
En este sentido, cuando hay acidificación el medio se torna amarillo, y cuando hay alcalinización el medio regresa al color morado o púrpura original.
Cuando ocurre desaminación de la lisina por la presencia de la enzima lisina desaminasa, se forma un color rojizo en la superficie, típico en los géneros Proteus, Providencia y algunas especies de Morganella.
Esto se debe a que durante el proceso de desaminación se forma el ácido alfa-ceto-carbónico, que reacciona con el citrato de amonio en presencia de oxígeno, lo que origina el color mencionado.
Por otra parte, las bacterias que producen sulfuro de hidrógeno quedarán en evidencia por la presencia del tiosulfato sódico (fuente de sulfuro) y del citrato férrico de amonio, que es el revelador del H2S.
Las bacterias que posean la enzima tiosulfato reductasa tienen la capacidad de actuar reduciendo el tiosulfato de sodio presente, formando sulfito y sulfuro de hidrógeno (H2S).
Este último es un gas incoloro, pero al reaccionar con la sal de hierro forma sulfuro ferroso metálico, que es un compuesto insoluble (precipitado negro visible).
Sin embargo, la capacidad de formación de H2S con este medio no es muy confiable, debido a que algunas bacterias lisina descarboxilasa negativas capaces de producir H2S no formarán el precipitado negro, pues la acidez del medio interfiere. Por ello se recomienda corroborar con otros medios que contengan hierro.
Los tubos deben leerse después de culminadas las 24 horas de incubación, de lo contrario se corre el riesgo de malinterpretar la reacción, reportando falsos negativos.
Hay que recordar que la primera reacción que ocurrirá será la fermentación de la glucosa, por tanto todos los tubos al cabo de 10 a 12 horas virarán a color amarillo.
Si al finalizar el tiempo de incubación (24 horas) se observa un fondo amarillo con una superficie morada o púrpura, la reacción es negativa. El color púrpura de la superficie corresponde a la alcalinización del medio por el uso de las peptonas.
Una reacción positiva es aquella en donde el fondo y la superficie del tubo son completamente púrpuras, es decir, vuelve al color original.
Por tanto, quien determina la positividad de la prueba es la base o fondo del medio. Si se tiene duda sobre el color se puede comparar con un tubo de LIA no inoculado.
Un tubo que evidencia la desaminación de la lisina tendrá una superficie color rojiza granate y un fondo amarillo (ácido), o todo el tubo color rojizo granate.
Esta reacción se interpreta como negativa para la descarboxilación de la lisina, pero positiva para desaminación de la lisina.
Esta reacción se define e interpreta en el bisel.
Una reacción positiva se observa por la aparición de un precipitado negro en todo el medio o parte de él. Generalmente entre el límite del bisel y la base.
Si el precipitado se da en todo el tubo no dejará ver las otras reacciones que ocurren en el medio.
Al interpretar la prueba los resultados se registran de la siguiente manera:
Primero se lee el bisel, luego el fondo o taco, después la producción de H2S, y finalmente la producción de gas.
Ejemplo: K/A + (-). Esto significa:
- K: Bisel alcalino (color morado)
- A: Fondo ácido (amarillo), es decir, reacción de descarboxilación negativa y desaminación negativa.
- +: Producción de sulfuro de hidrógeno
- (-): Sin gas.
Pese 35 gr del medio lisina agar hierro deshidratado y disuelva en un litro de agua destilada.
Caliente hasta disolver completamente el agar, para ello deje hervir por un minuto agitando frecuentemente. Distribuir 4 ml del medio en tubos de ensayo 13/100 con tapa de algodón.
Esterilizar en autoclave a 121°C por 15 minutos. Sacar del autoclave y dejar reposar de forma inclinada, de tal manera que quede una base profunda y un bisel corto.
Almacenar en nevera 2-8°C. Dejar atemperar antes de sembrar la cepa bacteriana.
El color del medio deshidratado es beige y del medio preparado color púrpura rojizo.
El pH final del medio preparado es 6,7 ± 0.2
El medio se torna amarillo con pH igual o menor a 5,2, y es morado a pH 6,5 para arriba.
Esta prueba, junto a otras pruebas bioquímicas, se utiliza para la identificación de bacilos de la familia Enterobacteriaceae.
El medio se siembra con un ansa recta o aguja, se realizan una o dos punciones hasta el fondo del tubo, y luego se estría la superficie del medio en zigzag.
Se incuba por 24 horas a 35-37°C en aerobiosis. Si es necesario se deja incubando por 24 horas más.
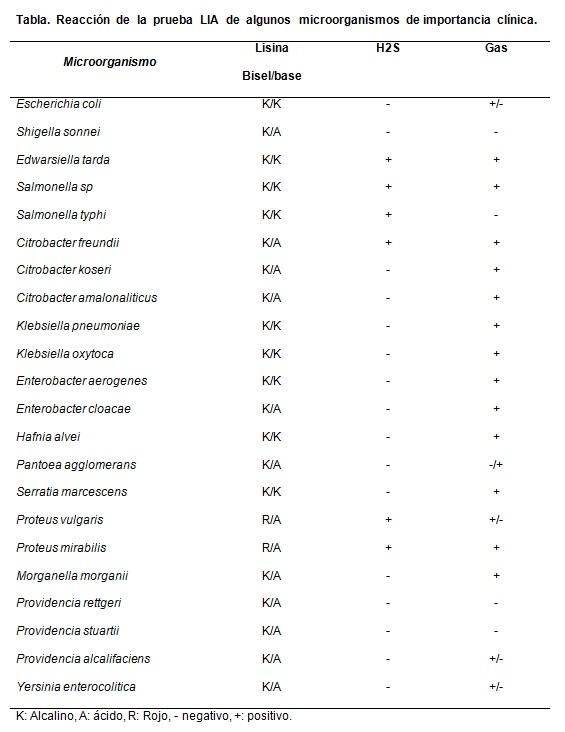
Es principalmente útil para diferenciar especies de Citrobacter lactosa negativos de Salmonellas sp.
- Mac Faddin J. (2003). Pruebas bioquímicas para la identificación de bacterias de importancia clínica. 3era ed. Editorial Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. 5ta ed. Editorial Panamericana S.A. Argentina.
- Laboratorios Britania. Lisina hierro agar. 2015. Disponible en: britanialab.com
- Laboratorios BD. BBL Lysine Iron Agar Slants. 2007. Disponible en: bd.com
- Laboratorios Valtek. Medio L.I.A. 2009. Disponible en: andinamedica.com
