Cloruro de plomo: propiedades, estructura, usos
El cloruro de plomo es una sal inorgánica cuya fórmula química es PbCln, donde n es el número de oxidación del plomo. Así, cuando el plomo está como +2 o +4, la sal es PbCl2 o PbCl4, respectivamente. Por lo tanto, existen dos tipos de cloruros para este metal.
De los dos, el PbCl2 es el más importante y estable; mientras que el PbCl4 es inestable y de menor utilidad. El primero es de naturaleza iónica, donde el catión Pb2+ genera interacciones electrostática con el anión Cl– para construir una red cristalina; y el segundo, es covalente, con enlaces Pb-Cl originando un tetraedro de plomo y cloro.

Otra diferencia entre ambos cloruros de plomo es que el PbCl2 es un sólido de cristales blancos con forma de agujas (imagen superior); mientras que el PbCl4 es un aceite amarillento que puede cristalizar a -15ºC. De entrada el PbCl2 es más estético que el PbCl4.
Además de lo ya mencionado, el PbCl2 se encuentra en la naturaleza como el mineral cotunita; en tanto que el PbCl4 no, ya que es susceptible a descomposiciones. Si bien a partir del PbCl4 se puede obtener el PbO2, del PbCl2 derivan una interminable variedad de compuestos organometálicos.
Índice del artículo
Las propiedades del cloruro de plomo dependen en esencia del número de oxidación del plomo; ya que, el cloro no cambia, sino que lo hace el modo en que interactúa con el plomo. Por lo tanto, deben abordarse ambos compuestos por separados; cloruro de plomo (II) por un lado, y cloruro de plomo (IV) por el otro.
Masa molar
278,10 g/mol.
Apariencia física
Cristales de colores blancos con formas de agujas.
Densidad
5,85 g/mL.
Punto de fusión
501ºC.
Punto de ebullición
950ºC.
Solubilidad en agua
10,8 g/L a 20ºC. Es poco soluble y debe calentarse el agua para que pueda disolverse una cantidad considerable.
Índice de refracción
2,199.
Masa molar
349,012 g/mol.
Apariencia física
Líquido aceitoso amarillento.
Densidad
3,2 g/mL.
Punto de fusión
-15ºC.
Punto de ebullición
50ºC. A temperaturas superiores se descompone liberando cloro gaseoso:
PbCl4(s) => PbCl2(s) + Cl2(g)
De hecho, esta reacción puede llegar a ser muy explosiva, por lo que se almacena el PbCl4 en ácido sulfúrico a -80ºC.
Al principio se hizo mención de que el PbCl2 es un compuesto iónico, de modo que consiste en iones Pb2+ y Cl– que construyen un cristal en el cual se establece una relación Pb:Cl igual a 1:2; es decir, hay el doble de aniones Cl– que cationes Pb2+.
El resultado es que se forman cristales ortorrómbicos cuyos iones pueden representarse con un modelo de esferas y barras como en la imagen inferior.

Esta estructura corresponde asimismo con la del mineral cotunita. Aunque se utilicen las barras para indicar una direccionalidad del enlace iónico, no debe confundirse con un enlace covalente (o por lo menos, puramente covalente).
En dichos cristales ortorrómbicos el Pb2+ (esferas grisáceas) tiene a nueve Cl– (esferas verdes) rodeándole, como si estuviera encerrado dentro de un prisma triangular. Por lo intrincado de la estructura, y la baja densidad iónica del Pb2+, a las moléculas se les dificulta solvatar el cristal; razón por la que es poco soluble en agua fría.
Cuando ni el cristal ni el líquido pueden resistir las altas temperaturas, los iones comienzan a vaporizarse como moléculas PbCl2 discretas; es decir, con enlaces covalentes Cl-Pb-Cl y un ángulo de 98º, como si fuera un boomerang. Se dice entonces que la fase gaseosa consiste de estas moléculas de PbCl2 y no de iones llevados por las corrientes de aire.
Cloruro de plomo (IV)
Mientras, el PbCl4 es un compuesto covalente. ¿Por qué? Porque el catión Pb4+ es más pequeño y tiene además una mayor densidad de carga iónica que el Pb2+, lo que ocasiona una mayor polarización de la nube electrónica del Cl–. El resultado es que en lugar de existir una interacción del tipo iónica Pb4+Cl–, se forma el enlace covalente Pb-Cl.
Considerando esto, se comprende la similitud entre el PbCl4 y, por ejemplo, el CCl4; ambos se presentan como moléculas individuales tetraédricas. Así, se explica por qué este cloruro de plomo es un aceite amarillento en condiciones normales; los átomos de Cl son pocos afines entre sí y “resbalan” cuando dos moléculas de PbCl4 se aproximan.
Sin embargo, cuando la temperatura desciende y las moléculas se vuelven más lentas, se incrementa la probabilidad y efectos de los dipolos instantáneos (el PbCl4 es apolar dada su simetría); y entonces, el aceite se congela como cristales hexagonales amarillos:
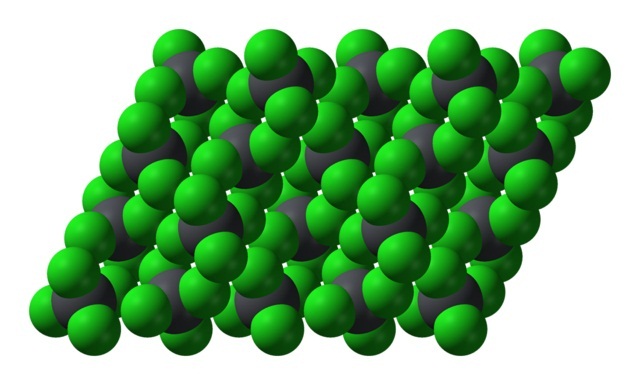
Nótese que cada esfera grisácea está rodeada de cuatro esferas verdes. Estas moléculas de PbCl4 “apretujadas” componen un cristal inestable y susceptible a descomponerse vigorosamente.
Los nombres: cloruro de plomo (II) y cloruro de plomo (IV) corresponden a los asignados de acuerdo a la nomenclatura Stock. Dado que el número de oxidación +2 es el menor para el plomo, y +4 el mayor, ambos cloruros pueden nombrarse según la nomenclatura tradicional como cloruro plumboso (PbCl2), y cloruro plúmbico (PbCl4), respectivamente.
Y por último está la nomenclatura sistemática, la cual resalta el número de cada átomo del compuesto. Así, el PbCl2 es el dicloruro de plomo, y el PbCl4 el tetracloruro de plomo.
No se conoce un uso práctico para el PbCl4 además de servir para la síntesis del PbO2. Sin embargo, el PbCl2 es de mayor utilidad y por eso solo se enlistarán a continuación algunos usos para este cloruro de plomo en específico:
– Debido a su naturaleza altamente luminiscente, se destina para dispositivos fotográficos, acústicos, ópticos y detectores de radiación.
– Al no absorber en la región del espectro infrarrojo, se utiliza para la fabricación de vidrios que transmitan este tipo de radiación.
– Ha formado parte de lo que llaman el vidrio aureno, un material atractivo de coloraciones azuladas iridiscentes empleado para fines ornamentales.
– Asimismo, siguiendo en el tema del arte, cuando se alcaniliza, PbCl2·Pb(OH)2 adquiere tonalidades blanquecinas intensas, utilizándose como el pigmento blanco de plomo. No obstante, se ha desaconsejado su uso debido a su elevada toxicidad.
– Derretido y mezclado con titanato de bario, BaTiO3, origina la cerámica titanato de bario y plomo Ba1−xPbxTiO3. Si un Pb2+ entra al BaTiO3, un Ba2+ debe abandonar el cristal para permitir su incorporación, y se dice entonces que ocurre un intercambio catiónico; por eso la composición del Ba2+ se expresa como 1-x.
– Y finalmente, a partir del PbCl2 se sintetizan varios compuestos organometálicos de plomo de fórmula general R4Pb o R3Pb-PbR3.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Lead(II) chloride. Recuperado de: en.wikipedia.org
- Formulación Química. (2019). Cloruro de plomo (IV). Recuperado de: formulacionquimica.com
- Clark Jim. (2015). The chlorides of carbon, silicon, and lead. Recuperado de: chemguide.co.uk
- Spectral and Optical Nonlinear studies on Lead Chloride (PbCl2) crystals. [PDF]. Recuperado de: shodhganga.inflibnet.ac.in
- National Center for Biotechnology Information. (2019). Lead chloride. PubChem Database; CID=24459. Recuperado de: pubchem.ncbi.nlm.nih.gov
