Alfa amilasa: características, estructura, funciones
La alfa amilasa (α-amilasa) es una enzima amilolítica del grupo de las endo amilasas que se encarga de la hidrólisis de los enlaces α-1,4 entre los residuos de glucosa que conforman distintos tipos de carbohidratos en la naturaleza.
Sistemáticamente conocida como sistemáticamente conocida como α-1,4-glucano 4-glucanohidrolas tiene una amplia distribución, puesto que se halla en animales, plantas y microorganismos. En los humanos, por ejemplo, las amilasas presentes en la saliva y las secretadas por el páncreas son de tipo α-amilasas.
Kuhn, en el año 1925, fue el primero en acuñar el término “α-amilasa” basándose en el hecho de que los productos de la hidrólisis que catalizan estas enzimas poseen configuración α. Más tarde, en 1968 se determinó que estas actúan preferentemente sobre sustratos de configuración estructural lineal y no ramificada.
Al igual que otras enzimas amilolíticas, la α-amilasa se encarga de la hidrólisis del almidón y de otras moléculas relacionadas como el glucógeno, produciendo polímeros más pequeños compuestos por unidades repetidas de glucosa.
Además de las funciones fisiológicas que tiene esta enzima en los animales, las plantas y los microorganismos que la expresan, la α-amilasa, junto con las demás clases de amilasas existentes, representan el 25% de las enzimas empleadas con fines industriales y biotecnológicos del mercado actual.
Muchas especies de hongos y bacterias son la principal fuente de obtención de las α-amilasas que se emplean con más frecuencia en la industria y la experimentación científica. Esto se debe principalmente a su versatilidad, su fácil obtención, su sencillo manejo y a los bajos costos relativos a su producción.
Índice del artículo
Las α-amilasas que se encuentran en la naturaleza pueden tener rangos óptimos de pH muy diferentes para su funcionamiento; por ejemplo, el óptimo para las α-amilasas animales y vegetales está entre 5.5 y 8.0 unidades de pH, pero algunas bacterias y hongos tienen enzimas más alcalinas y más otras acídicas.
Las enzimas presentes en la saliva y el páncreas de mamíferos trabajan mejor a pH cercanos a 7 (neutros) además, requieren iones cloruro para alcanzar su máxima actividad enzimática y son capaces de unirse a iones divalentes de calcio.
Ambas enzimas animales, las salivales y las pancreáticas, son producidas en los organismos por mecanismos independientes que involucran células y glándulas específicas y que probablemente no se relacionan con las enzimas presentes en el torrente circulatorio y otras cavidades corporales.
Tanto el pH como la temperatura óptimos para el funcionamiento de estas enzimas depende enormemente de la fisiología del organismo que se considere, pues existen microorganismos extremófilos que crecen en condiciones muy particulares respecto a estos y muchos otros parámetros.
Por último, en términos de la regulación de su actividad, una característica compartida entre las enzimas del grupo de las α-amilasas es que estas, al igual que otras amilasas, pueden ser inhibidas por iones metálicos pesados como el mercurio, el cobre, la plata y el plomo.
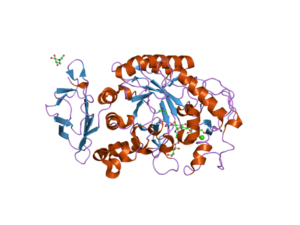
La α-amilasa es una enzima multidominio que, en animales y plantas, tiene un peso molecular aproximado de 50 kDa y diferentes autores concuerdan en que las enzimas pertenecientes a esta familia de glicohidrolasas son enzimas con más de diez dominios estructurales.
El dominio central o dominio catalítico es muy conservado y se conoce como el dominio A, que consiste en un pliegue simétrico de 8 láminas β-plegadas arregladas en forma de “barril” que están rodeadas por 8 hélices alfa, por lo que también se puede encontrar en la literatura como (β/α)8 o barril tipo “TIM”.
Es importante señalar que en el extremo C-terminal de las láminas β del dominio A se encuentran los residuos aminoacídicos conservados que están implicados en la catálisis y en la unión del sustrato y que este dominio se ubica en la región N-terminal de la proteína.
Otro de los dominios más estudiados de estas enzimas es el llamado dominio B, que sobresale entre la lámina β-plegada y la hélice alfa número 3 del dominio A. Este juega un papel fundamental en la unión del sustrato y de calcio divalente.
Dominios adicionales han sido descritos para las enzimas α-amilasas, como los dominios C, D, F, G, H e I, que se localizan en frente o atrás del dominio A y cuyas funciones no se conocen con exactitud y dependen del organismo que se estudia.
El peso molecular de las α-amilasas depende, así como otras de sus características bioquímicas y estructurales, del organismo que se estudie. Así pues, las α-amilasas de muchos hongos y bacterias tienen pesos tan bajos como 10 kDa y tan altos como 210 kDa.
El alto peso molecular de algunas de estas enzimas microbianas a menudo se relaciona con la presencia de glicosilaciones, aunque la glicosilación de proteínas en bacterias es bastante rara.
En los animales, las α-amilasas son las responsables de los primeros pasos en el metabolismo del almidón y el glucógeno, pues se encargan de su hidrólisis a fragmentos más pequeños. Los órganos del sistema gastrointestinal encargados de su producción en los mamíferos son el páncreas y las glándulas salivales.
Además de su evidente función metabólica, la producción de α-amilasas producidas por las glándulas salivales de muchos mamíferos, activada por acción de la norepinefrina, es considerada por muchos autores como un importante marcador “psicobiológico” de estrés en el sistema nervioso central.
También tiene funciones secundarias en la salud bucal, pues su actividad funciona en la eliminación de bacterias bucales y en la prevención de su adhesión a las superficies orales.
En las plantas, las α-amilasas juegan un papel primordial en la germinación de las semillas, pues son las enzimas que hidrolizan el almidón presente en el endospermo que nutre el embrión en su interior, proceso controlado esencialmente por la giberelina, una fitohormona.
Las enzimas pertenecientes a la familia de las α-amilasas tienen múltiples aplicaciones en muchos contextos distintos: industriales, científicos y biotecnológicos, etc.
En las grandes industrias de procesamiento de almidón, las α-amilasas son popularmente empleadas para la producción de glucosa y fructosa, así como para la producción de pan con texturas mejoradas y con mayor capacidad de levado.
En el ámbito biotecnológico, mucho interés existe respecto al mejoramiento de las enzimas empleadas comercialmente, en aras de mejorar su estabilidad y rendimiento en diferentes condiciones.
- Aiyer, P. V. (2005). Amylases and their applications. African Journal of Biotechnology, 4(13), 1525–1529.
- Bernfeld, P. (1960). Amylases, a and B. In Enzymes of Carbohydrate Metabolism (Vol. I, pp. 149–158).
- Granger, D. A., Kivlighan, K. T., El, M., Gordis, E. B., & Stroud, L. R. (2007). Salivary a-Amylase in Biobehavioral Research. Recent Developments and Applications. Ann. N.Y. Acad. Sci., 1098, 122–144.
- Monteiro, P., & Oliveira, P. (2010). Application of Microbial a-Amylase in Industry- A review. Brazilian Journal of Microbiology, 41, 850–861.
- Reddy, N. S., Nimmagadda, A., & Rao, K. R. S. S. (2003). An overview of the microbial α-amylase family. African Journal of Biotechnology, 2(12), 645–648.
- Salt, W., & Schenker, S. (1976). Amylase- Its clinical significance: a Review of the Literature. Medicine, 55(4), 269–289.
- Svensson, B., & Macgregor, E. A. (2001). Relationship of sequence and structure to specificity in the a-amylase family of enzymes. Biochimica et Biophysica Acta, 1546, 1–20.
- Thoma, J. A., Spradlin, J. E., & Dygert, S. (1925). Plant and Animal Amylases. Ann. Chem., 1, 115–189.
