Enlace covalente doble: concepto, características, ejemplos

¿Qué es un enlace covalente doble?
Los enlaces covalentes dobles son enlaces químicos en los que dos átomos comparten dos pares de electrones. Es decir que son enlaces covalentes formados por un total de cuatro electrones de valencia que giran en torno a dos átomos.
Los enlaces dobles son muy comunes en los compuestos orgánicos. Por ejemplo, todos los alquenos poseen un enlace doble carbono-carbono. Muchos otros grupos funcionales tales como los aldehídos, las cetonas, los ácidos carboxílicos y las amidas también poseen enlaces covalentes dobles entre carbono y oxígeno. Otros más, como las iminas tienen enlaces covalentes dobles C=N.
Los enlaces dobles tienen muchas características que los distinguen de otros tipos de enlaces covalentes como los enlaces simples y los enlaces triples. Difieren en la forma de las moléculas que los contienen, en la longitud y fuerza de enlace y otras características relacionadas con sus propiedades químicas.
Características del enlace covalente doble
Están formados por 4 electrones
La razón por la que se denominan enlaces dobles es porque contienen el doble de electrones de un enlace covalente simple, el cual se forma cuando dos átomos comparten dos electrones de valencia. Esto quiere decir que todo enlace doble contiene 4 electrones.
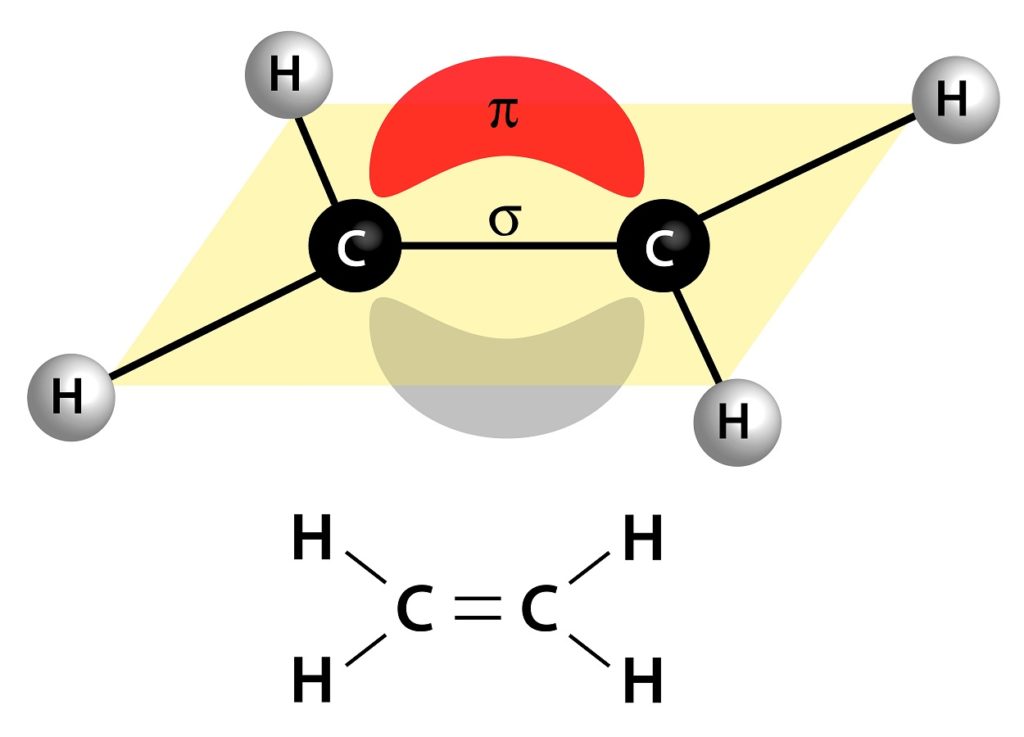
Están formados por un enlace sigma (σ) y un enlace pi (π)
De los 4 electrones que forman un enlace doble, 2 de ellos se encuentran yendo y viniendo entre un átomo y otro, pasando por el centro de los dos. A este par de electrones se les llama electrones sigma, ya que forman un enlace sigma (σ).
El otro par de electrones se encuentra flotando por encima y por debajo de los dos átomos haciendo una especie de sándwich. A estos electrones se les llama electrones pi y forman un enlace pi (π).
Juntos, el enlace sigma y el enlace pi forman el enlace covalente doble.
Pueden ser polares o apolares
Dependiendo de la electronegatividad de los átomos que están unidos por medio de un enlace covalente doble, éste puede ser polar o apolar.
Por ejemplo, un enlace covalente doble C=C será un enlace apolar, ya que ambos átomos son iguales y tienen la misma electronegatividad. En cambio, un enlace covalente doble C=O será polar, ya que el oxígeno es mucho más electronegativo que el carbono.
Son más fuertes que los enlaces simples
Romper un enlace doble es más difícil que romper un enlace simple entre los mismos dos átomos. Esto se debe a que, para romper un enlace doble, se debe romper tanto un enlace sigma (que es igual al del enlace simple) como un enlace pi. Como hay que romper dos enlaces en lugar de uno, el enlace doble es más fuerte que el simple.
Son más débiles que los enlaces triples
Comparado con el enlace triple, el enlace doble es más débil y más fácil de romper. La razón es la misma que antes, solo que, en este caso, el enlace doble tiene menos enlaces que romper en comparación con el enlace triple.
Son más cortos que los enlaces simples
Al ser enlaces más fuertes que los enlaces simples, los enlaces dobles son capaces de acercar más a los átomos enlazados que los enlaces simples. Por esta razón, si se compara un enlace doble C=C con un enlace simple C-C, el primero siempre es más corto que el segundo.
Son más largos que los enlaces triples
Nuevamente, al ser más fuerte el enlace triple que el enlace doble, el enlace triple es más corto. Esto implica que los enlaces covalentes dobles son más largos que los triples.
Son enlaces rígidos.
Los enlaces covalentes simples son bastante flexibles y además pueden rotar libremente. En cambio, los enlaces dobles son rígidos, no son flexibles y no se pueden rotar, ya que se rompería el enlace pi que se mencionó anteriormente.
Representan insaturaciones
Una molécula que posee un enlace doble, obligatoriamente tendrá dos átomos de hidrógeno menos enlazados de los que podría tener. Por esta razón, se dice que un enlace doble representa una insaturación (cada insaturación corresponde a 2 hidrógenos).
Forman moléculas planas con forma de triángulo
Un átomo de carbono que forma un enlace covalente doble y otros dos enlaces simples, siempre forma una molécula plana en la que los tres enlaces están apuntando a los extremos de un triángulo. A esta forma se le llama geometría plana trigonal.
Ejemplos de enlaces covalentes dobles
Enlace C=C en el etileno
El etileno es uno de los ejemplos más sencillos de un enlace covalente doble, en este caso entre dos átomos de carbono.
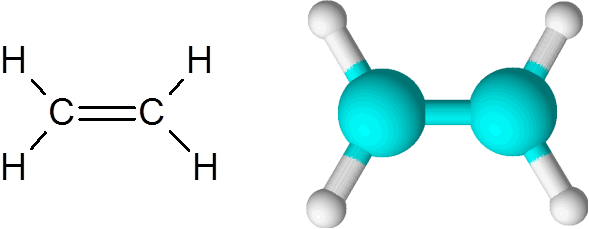
La molécula es completamente plana y no es posible rotar el enlace en ninguna dirección. Este enlace doble es totalmente apolar, ya que está enlazando a dos átomos iguales.
Enlace C=O en la acetona
Todas las cetonas contienen un grupo carbonilo, el cual consisten en un átomo de carbono y un átomo de oxígeno unidos por medio de un enlace covalente doble.
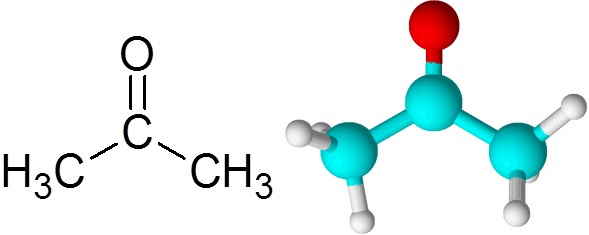
Cada átomo aporta dos electrones desapareados para formar tanto el enlace pi como el enlace sigma que conforman el enlace doble. La mayor parte de las reacciones químicas que le ocurren a las cetonas se deben al enlace doble C=O.
El enlace O=O en la molécula de ozono (O3)
En este caso, el átomo central de oxígeno está enlazado a otros dos átomos de oxígeno. Uno de los dos enlaces está formado por 4 electrones por lo que corresponde a un enlace covalente doble. Los tres átomos y un par de electrones sin compartir que posee el átomo de oxígeno central se encuentran todos en el mismo plano de la pantalla apuntando a las esquinas de un triángulo.
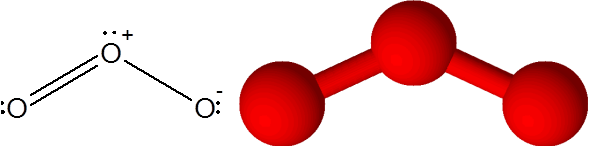
El ozono tiene la particularidad de que el enlace doble puede “saltar” de uno de los oxígenos terminales al otro. De hecho, lo hace muy rápidamente por medio de un proceso denominado resonancia.
Enlaces C=C en el butadieno (C4H6)
El butadieno es un ejemplo de un compuesto orgánico que posee dos enlaces covalentes dobles C=C.
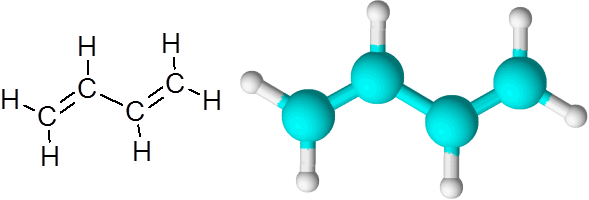
Cuando los enlaces dobles se encuentran en esta forma, separados por un solo enlace simple, se dice que son enlaces dobles conjugados.
