Piridina: estructura, propiedades, usos, toxicidad, síntesis
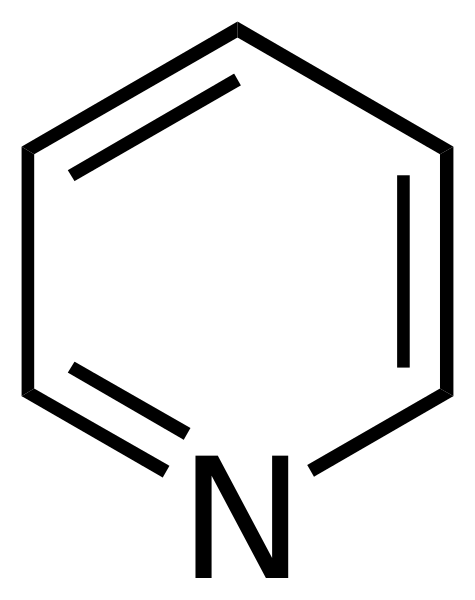
La piridina es una amina aromática cuya fórmula química es C5H5N. Es la versión nitrogenada del benceno, pues un grupo –CH= ha sido sustituido por un átomo de nitrógeno (N). Junto con el pirrol, la piridina conforma el grupo de las aminas aromáticas más simples de todas.
Inicialmente se produjo la piridina a partir del alquitrán de la hulla, pero era un método de poco rendimiento. Esto llevó a la creación de varios métodos para su síntesis química, prevaleciendo aquel en el que se utiliza la reacción del formaldehido, acetaldehído y amoníaco.
La piridina se obtuvo por vez primera por Thomas Anderson (1843), un químico escoses, quien mediante el calentamiento de carnes y huesos animales produjo un aceite del cual se purificó la piridina.

La piridina se utiliza como materia prima para la síntesis de compuestos que eliminan y controlan la proliferación de insectos, hongos, hierbas, etc. Asimismo, se utiliza en la elaboración de numerosos medicamentos y vitaminas, además de utilizarse como solvente.
La piridina es un compuesto tóxico que en forma crónica puede producir daños en el hígado, los riñones y el funcionamiento del sistema nervioso central. La piridina puede ingresar al organismo por ingestión, inhalación y difusión a través de la piel. Se le conoce en el ámbito químico por ser una sustancia capaz de ocasionar impotencia en los hombres.
Índice del artículo
- 1 Estructura de la piridina
- 2 Propiedades de la piridina
- 2.1 Apariencia física
- 2.2 Masa molar
- 2.3 Densidad
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Solubilidad
- 2.7 Presión de vapor
- 2.8 Densidad de vapor
- 2.9 Índice de refracción (nD)
- 2.10 Viscosidad
- 2.11 Momento dipolar
- 2.12 Punto de ignición
- 2.13 Temperatura de auto-ignición
- 2.14 Descomposición
- 2.15 Corrosión
- 2.16 pH
- 2.17 Basicidad y reactividad
- 3 Usos de la piridina
- 4 Toxicidad
- 5 Síntesis
- 6 Reacciones
- 7 Referencias
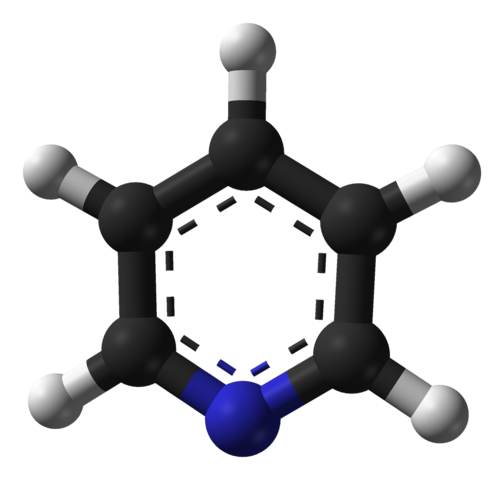
En la imagen superior se muestra la estructura molecular de la piridina representada por un modelo de esferas y barras. Como puede verse, su molécula es muy similar a la de benceno, con la única diferencia de que posee uno de sus carbonos (esferas negras) sustituido por nitrógeno (esfera azul).
El nitrógeno, por ser más electronegativo, atrae densidad electrónica hacia sí, lo cual crea un momento dipolar permanente en la piridina. Por lo tanto, las moléculas de piridina interaccionan mediante fuerzas dipolo-dipolo.
Los átomos de hidrógeno son las regiones más pobres en electrones, de manera que se orientarán en dirección del átomo de nitrógeno de una molécula vecina.
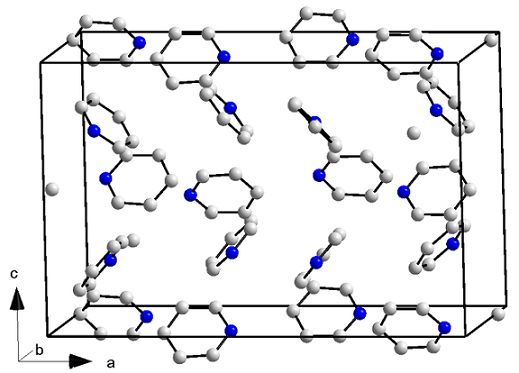
Las moléculas de piridina cuentan no solo con las fuerzas dipolo-dipolo, sino también con interacciones propias de los anillos aromáticos. Así, estas moléculas logran posicionarse ordenadamente para originar un cristal de estructura ortorrómbica (imagen superior) a una temperatura de -41,6 °C.

Líquido incoloro, con un olor penetrante, semejante al del pescado.
79,1 g/mol
0,9819 g/mL
-41,6 ºC
115,2 ºC
Es miscible con el agua, y también con el alcohol, éter, éter de petróleo, aceites y muchos líquidos orgánicos en general.
16 mmHg a 20 ºC.
2,72 con relación al agua = 1
1,5093
0,88 cP
2,2 D
21 ºC
482 ºC
Cuando se calienta a descomposición emite un humo de cianuro.
La piridina en forma líquida ataca algunas formas de plásticos, cauchos y recubrimientos.
8,5 (solución 0,2 M en agua)
La piridina es una base débil. Es una amina terciaria cuya solución al 0,2 M en agua produce un pH de 8,5. Posee poca afinidad por los electrones debido a la electronegatividad del nitrógeno, por lo que sus carbonos no suelen sufrir una sustitución electrofílica.
La piridina experimenta sustitución nucleofílica, preferentemente en las posiciones C4 y C2 del anillo. Debido a su capacidad para donar electrones, la piridina es más resistente a la oxidación que el benceno y reacciona violentamente con el ácido sulfúrico, el ácido nítrico y el anhídrido maleico.
La piridina es un precursor de los herbicidas Paraquat y Diquat. De la misma forma, sirve para la síntesis del insecticida Clorpirifos, cuyo paso inicial es la cloración de la piridina. También es la materia prima inicial para la obtención del fungicida a base de la piritiona.
La piridina es un solvente polar, usado para las reacciones de deshalogenación y la extracción de antibióticos. La piridina se usa como solvente en las industrias de la pintura y el caucho, y también en los laboratorios de investigación como solvente en la extracción de hormonas vegetales.
La piridina sirve de punto inicial en la síntesis de cetilpiridinio y de laurilpiridinio, compuestos que se utilizan como antisépticos en productos de cuidado oral y dental. La molécula de piridina forma parte de la estructura química de numerosos medicamentos.
Por ejemplo, el esmeprazol, utilizado en el tratamiento del reflujo gastroesofágico. La loratidina es otro medicamento preparado a base de piridina, conocido con el nombre de Claritin, el cual es usado como tratamiento de los procesos alérgicos.
Las tabletas de piridina (fenazopiridina) son utilizadas en el tratamiento sintomático de una irritación del tracto urinario, que viene acompañado, en algunos casos, de dolor, ardor y la urgencia de orinar. La fenazopiridina es un colorante que cumple una función de analgésico en el tracto urinario.
El di-acylhidrazina es un derivado de la piridina que posee una actividad antibacteriana que ejerce sobre las bacterias gram negativas, tales como la E. coli, y las bacterias gram positivas, como la S. albus.
La piridina sirve de base para el thiazolo[5,4-6] piridina, compuesto con actividad antiviral, especialmente contra el virus β-Mass de la influenza. El 2-acetilpiridina, un derivado de la piridina, tiene gran actividad antitumoral y es un inhibidor de la leucemia.
La piridina se utiliza en la fabricación de vitaminas, productos de caucho, adhesivos, pinturas e insecticidas. Se usa asimismo en la desnaturalización del alcohol y en la tinción de algunos textiles.
El 20 % de la piridina se utiliza en la preparación de la piperidina. La piperidina interviene en la vulcanización y en la agricultura.
La piridina es utilizada además en la síntesis de resinas policarbonadas, como saborizante de alimentos y como reactivo para la detección del cianuro.
– La piridina ingresa al organismo principalmente por inhalación y por difusión a través de la piel. Una exposición aguda a la piridina puede producir por contacto irritación y quemaduras en los ojos y la piel.
– La piridina puede originar en la piel dermatitis y alergia. El desarrollo de la alergia puede estar acompañado además de comezón y salpullido.
– La inhalación de la piridina puede producir irritación de la nariz y garganta, acompañada de tos y una respiración asmática jadeante.
– Por ingestión, la piridina puede causar náuseas, vómitos, diarrea y dolor abdominal. Asimismo, la incorporación de una dosis alta de piridina al organismo puede causar: dolor de cabeza, fatiga, desvanecimiento, aturdimiento, mareos, confusión y eventualmente coma y muerte.
– Los órganos más afectados por la acción de la piridina son el hígado, los riñones, los genitales masculinos y el sistema nervioso central. También puede actuar sobre la médula ósea, induciendo la producción de plaquetas sanguíneas. No se ha evidenciado en experimentos con animales una acción carcinogénica de la piridina.
La OSHA estableció un límite de exposición en el aire de 5 ppm por jornada laboral de 8 horas.
Los primeros métodos de obtención de la piridina se basaron en su extracción de materiales orgánicos. Thomas Anderson (1843) obtuvo por vez primera la piridina mediante calentamiento de carnes y huesos de animales. En una primera etapa, Anderson produjo un aceite del cual logró destilar la piridina.
Tradicionalmente, la piridina se obtenía del alquitrán de la hulla o de la gasificación del carbón. Estos procedimientos eran engorrosos y de poco rendimiento, ya que la concentración de piridina en estas materias primas era muy baja. Hacía falta, pues, un método de síntesis.
Aunque existen muchos métodos para la síntesis de piridina, se sigue usando principalmente el procedimiento de Chichibabin introducido en 1923. En este método la piridina se sintetiza a partir de la reacción de formaldehido, acetaldehído y amoníaco, los cuales son reactivos baratos.
En la primera etapa, reaccionan el formaldehido y el acetaldehído para formar el compuesto acroleína, en una reacción de condensación de Knoevenagel, formándose además agua.
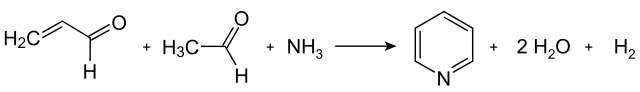
Finalmente, en una segunda etapa, la acroleína reacciona con formaldehido y amoníaco para formar dihidropiridina. Posteriormente, la dihidropiridina es oxidada a piridina en una reacción a 350 -550 ºC en presencia de un catalizador sólido, por ejemplo, sílice-alúmina.
Estas sustituciones no suelen producirse debido a la baja densidad electrónica de la piridina.
La sulfanación presenta mayor dificultad que la nitración. Pero la bromación y cloración ocurren con mayor facilidad.
El sitio de oxidación en la piridina es el átomo de nitrógeno, siendo la oxidación producida por los perácidos (ácidos que tienen un grupo OOH). La oxidación del nitrógeno promueve la sustitución electrofílica en los carbonos 2 y 4 de la piridina.
La piridina puede experimentar varias sustituciones nucleofílicas debido a la baja densidad electrónica de los carbonos del anillo de piridina. Estas sustituciones ocurren con mayor facilidad en la molécula de piridina modificada por bromo, cloro, flúor o ácido sulfónico.
Los compuestos que realizan los ataques nucleofílicos a la piridina suelen ser: alcóxidos, tiolatos, aminas y amoníaco.
La piridina puede ser dimerizada mediante reacciones radicales. La dimerización radical de piridina se realiza con sodio elemental o níquel Raney, pudiéndose producir 4,4’-biperidina o 2,2’-biperidina.
Los ácidos, según Lewis, se agregan fácilmente al átomo de nitrógeno de la piridina, formando sales de piridinio. La piridina es una base de Lewis que dona un par de electrones.
La piperidina se produce por la hidrogenación de la piridina con níquel, cobalto o rutenio. Esta reacción es realizada a altas temperaturas acompañada por el uso de un catalizador.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Pyridine. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Pyridine. PubChem Database., CID=1049. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Laura Foist. (2020). Pyridine: Structure, Formula & Physical Properties. Study. Recuperado de: study.com
- Ataf Ali Altaf, Adnan Shahzad, Zarif Gul, Nasir Rasool, Amin Badshah, Bhajan Lal, Ezzat Khan. (2015). A Review on the Medicinal Importance of Pyridine Derivatives. Journal of Drug Design and Medicinal Chemistry. Vol. 1, No. 1, pp. 1-11. doi: 10.11648/j.jddmc.20150101.11
- WebMD. (2020). Pyridin Tablet. Recuperado de: webmd.com
- New Jersey Department of Health and Senior Services. (2002). Pyridine. [PDF]. Recuperado de: nj.gov
